Zuurstof: Het element
 Zuurstof is een scheikundig element met symbool O (van oxygen) en atoomnummer 8. Het is een lid van de chalcogeen groep in het periodiek systeem en een zeer reactive nietmetaal en oxidatiemiddel. Het vormt gemakkelijk verbindingen met de meeste elementen. Zuurstof is de derde meest voorkomende element in het universum, na waterstof en helium. Bij STP (Standard Temperature, Pressure) verbinden twee atomen zuurstof zich tot een molecuul O2, een twee-atomig kleurloos, geurloos en smaakloos gas. Zuurstof is ontdekt als element door Carl Wilhelm Scheele in 1772.
Zuurstof is een scheikundig element met symbool O (van oxygen) en atoomnummer 8. Het is een lid van de chalcogeen groep in het periodiek systeem en een zeer reactive nietmetaal en oxidatiemiddel. Het vormt gemakkelijk verbindingen met de meeste elementen. Zuurstof is de derde meest voorkomende element in het universum, na waterstof en helium. Bij STP (Standard Temperature, Pressure) verbinden twee atomen zuurstof zich tot een molecuul O2, een twee-atomig kleurloos, geurloos en smaakloos gas. Zuurstof is ontdekt als element door Carl Wilhelm Scheele in 1772.
Algemene eigenschappen van het element zuurstof
| Naam | Symbool | Kleur | Atoom- nummer | Atoom- massa | Catagorie | Groep Blok | Periode | Elektron- configuratie |
|---|---|---|---|---|---|---|---|---|
| Zuurstof | O | Gas: kleurloos vloeibaar: lichtblauw | 8 | Standaard 15,999 | Tweeatomig niet-metaal | groep 16 P-blok | Periode 2 | [He] 2s2 2p4 per schil 2, 6 |
Fysische eigenschappen van het element zuurstof
| Aggre- gatie- toestand | Smelt- punt | Kook- punt | Dichtheid bij 0 °C en 101.325 kPa | Tripelpunt | Kritische punt | Smelt- warmte | Verdamp- ings- warmte |
|---|---|---|---|---|---|---|---|
| Gas | 54,36 K −218.79 °C −361.82 °F | 90,188 K −182.962 °C −297.332 °F | 1,429 g/dm3 vloeibaar (KP) 1,141 kg/dm3 | 54,361 K, 0,1463 kPa | 154,581 K, 5,043 MPa | (O2) 6,82 kJ/mol | (O2) 6,82 kJ/mol |
Eigenschappen van het zuurstof atoom
| Oxidatie toestanden | Electro- negativiteit | Ionisatie- energies KJ/mol | atoom- radius | Kristal- structuur | Warmte- geleidings- vermogen W/m.K | Magnet- isme | Ontdekking als element |
|---|---|---|---|---|---|---|---|
| 2, 1, −1, −2 | Pauling: 3,44 | 1st: 1313,9 2nd: 3388,3 3rd: 5300,5 | Covalente radius 66±2 pm Van der Waals radius 152 pm | Kubisch | 26.58×10−3 | para- mag- netisch | Carl Wilhelm Scheele 1772 |
Stabielste isotopen van het element zuurstof
| Isotoop | NA | Halveringstijd | Verval via | Vervalenergie(MeV) | Vervalproducten |
|---|---|---|---|---|---|
| 16 O | 99,76% | 16 O is stabiel met 8 neutronen | --- | --- | --- |
| 17 O | 0,039% | 17 O is stabiel met 9 neutronen | --- | --- | -- |
| 18 O | 0,201% | 18 O is stabiel met 10 neutronen | --- | --- | --- |
 Zuurstof is voor het eerst ontdekt in 1772 door de Zweed Karl Wilhelm Scheele / Bron: Publiek domein, Wikimedia Commons (PD)
Zuurstof is voor het eerst ontdekt in 1772 door de Zweed Karl Wilhelm Scheele / Bron: Publiek domein, Wikimedia Commons (PD)Het voorkomen van zuurstof op aarde
Veel organische moleculen in levende organismen, zoals eiwitten, nucleïnezuren, koolhydraten en vetten, bevatten zuurstof. Dat geldt ook voor de belangrijke anorganische verbindingen zoals de bestanddelen van schelpen, tanden en botten. Het merendeel van de massa van levende organismen is zuurstof als onderdeel van water, dat hoofdbestanddeel is van levensvormen en tweederde van het menselijk lichaamsgewicht vormt.Zuurstof is een belangrijk onderdeel van de atmosfeer en is onmisbaar voor het aardse leven. Het wordt voortdurend aangevuld door de fotosynthese in levende organismen, die met behulp van zonne-energie zuurstof uit water halen. Zuurstof wordt industrieel onder andere geproduceerd door gefractioneerde destillatie van vloeibare lucht. Ook kan zuurstof verkregen worden door elektrolyse van water.
 Periodiek systeem van elementen atoomnummer zuurstof is 8 / Bron: Cepheus, Wikimedia Commons (Publiek domein)
Periodiek systeem van elementen atoomnummer zuurstof is 8 / Bron: Cepheus, Wikimedia Commons (Publiek domein)Elementaire zuurstof wordt geproduceerd door cyanobacteriën, algen en planten. Zuurstof is giftig voor anaerobe organismen, die het eerste leven op aarde waren, tot het voor hun giftige zuurstof werd gevormd in de atmosfeer. Elementaire O2 begon toe te nemen in de atmosfeer ongeveer 2,5 miljard jaar geleden tijdens de "zuurstof crisis", ongeveer een miljard jaar na de eerste verschijning van de genoemde anaerobe organismen. Twee-atomig zuurstof O2 vormt 20,8% van het volume van de lucht. Zuurstof is de meest voorkomende element in de aardkorst, het maakt deel uit van oxiden als siliciumdioxide, oxiden die samen bijna de helft van de massa van de aardkorst vormen.De zuurstofcrisis refereert naar het massa-uitsterven van de primitieve anaerobe levensvormen op aarde veroorzaakt door de toename van de, voor hun dodelijke, zuurstof in de atmosfeer. Deze voor de mens belangrijke gebeurtenis, heeft zich circa 2,5 miljard jaar geleden voltrokken.
Molecuulstructuur en allotropen van zuurstof
In zuurstof O2 worden de twee zuurstofatomen chemisch aan elkaar gebonden door een covalente binding. De gemeenschappelijke allotroop van elementaire zuurstof op aarde is zuurstof O2.Allotroop ozon (O3)
Ozon O3 is een allotroop van elementair zuurstof die UVB straling absorbeert, waardoor de hoger gelegen ozonlaag de biosfeer tegen ultraviolette straling beschermt. Het is een beschermend schild voor het leven op aarde. Ozon en is een reactieve allotroop die schadelijk is voor longweefsel.Allotroop tetraoxygen (O4)
De metastabiele molecuul (O4) werd ontdekt in 2001. Aangetoond werd in 2006 dat deze structuur onder druk tot 20 GPa een rhombohedral cluster is. Dit cluster is een veel krachtiger oxidator dan O2 of O3 en waarschijnlijk gebruikt kan worden in raketbrandstof.Toelichting op de fysische eigenschappen
Zuurstof is beter oplosbaar in water dan stikstof. De oplosbaarheid van zuurstof in water is temperatuur afhankelijk; ongeveer twee keer zoveel (14.6 mg/ dm3) lost op bij 0 °C dan bij 20 °C (7,6 mg/ dm3). Zuiver vloeibaar O2 wordt gewoonlijk verkregen door de gefractioneerde destillatie van vloeibare lucht. Vloeibare zuurstof kan ook worden geproduceerd door condensatie van lucht met vloeibare stikstof als koelmiddel. Het is een zeer reactieve stof en moet worden gescheiden van brandbare stoffen.Cryogene(lat: koudmakend) stoffen zijn tot vloeistof gecondenseerde gassen met zeer lage temperaturen van -273 ºC tot –130 ºC, in de buitenlucht gaan ze kokend over in de gasvorm.Koud water heeft meer opgeloste O2
De verhoogde oplosbaarheid van zuurstof O2 bij lagere temperaturen heeft gevolgen voor het leven in de oceaan. Koude oceanen hebben een hogere dichtheid van leven als gevolg van een hogere zuurstofgehalte. Vervuild water met voedingsstoffen voor planten, zoals nitraten of fosfaten stimuleren de algengroei met alle consequenties daarvan.Fotosynthese en ademhaling
Fotosynthese splitst water in waterstof en zuurstof O2 en neemt CO2 op.In de natuur, wordt vrije zuurstof geproduceerd door het licht-aangedreven splitsing van water tijdens fotosynthese. Volgens schattingen, hebben groene algen en cyanobacteria in maritieme omgevingen ongeveer 70% van de vrije zuurstof geproduceerd op aarde en de rest geproduceerd wordt door landplanten. Oceanen produceren circa 45% van de zuurstof in de aardse atmosfeer per jaar. Een vereenvoudigde algemene formule voor fotosynthese is:
- 6 CO2 + 6 H2O + fotonen → C6H12O6 + 6 O2
In woorden:
- koolstofdioxide + water + zonlicht → glucose + Zuurstof
Moleculaire zuurstof O2, essentieel voor cellulaire ademhaling, bevindt zich in alle aerobe organismen. Zuurstof in mitochondriën genereert adenosine trifosfaat (ATP). De reactie voor aerobe ademhaling in wezen het omgekeerde van de fotosynthese en wordt vereenvoudigd weergegeven als:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 2880 kJ/ mol
Reactieve zuurstofsoorten, zoals oxide-ion (O2) en waterstofperoxide (H2O2), zijn gevaarlijk bijproducten van zuurstofgebruik in organismen. Delen van het immuunsysteem echter maken peroxide, superoxide en singlet zuurstof om microben te vernietigen.
Een volwassen mens in rust inhaleert 1,8-2,4 gram zuurstof per minuut. Dit komt neer op meer dan 6 miljard ton zuurstof ingeademd door de mensheid per jaar.
Zuurstof in de atmosfeer
Globale gang van zaken bij de opbouw van zuurstof in de atmosfeer. Fase 1: Geen zuurstof productie. fase 2: Zuurstof productie, maar wordt opgenomen in de oceanen en in zeebodem mineralen. Fase 3 en 4: zuurstof vult geleidelijk de atmosfeer. Zuurstof was dus afwezig in de atmosfeer voordat fotosynthetische archaea en bacteriën geëvolueerd waren, waarschijnlijk ongeveer 3,5 miljard jaar geleden. Vrije zuurstof verscheen voor het eerst in grote hoeveelheden tussen 3,0 en 2,3 miljard jaar geleden. Voor de eerste miljard jaar, werd de vrije zuurstof die door archaea en bacteriën werd geproduceerd gebonden door onder andere ijzer om ijzeroxiden te vormen in de oceanen. Door de aanwezigheid van grote hoeveelheden opgeloste en vrije zuurstof in de oceanen en in de atmosfeer is het grootste deel van de anaerobe organismen die toen leefden uitgestorven (tijdens de zuurstof crisis) ongeveer 2,4 miljard jaar geleden. Cellulaire zuurstof ademhaling stelt aerobe organismen in staat om veel meer ATP te produceren dan de anaerobe organismen de eerste levensvormen. Celademhaling O2 vindt plaats in alle complexe meercellige organismen, zoals planten en dieren.Opslag van zuurstof
Opslag van zuurstof in hogedruk zuurstoftanks. Om economische redenen wordt zuurstof vervoerd als vloeistof, aangezien één liter vloeibare zuurstof gelijk is aan 840 liter gasvormige zuurstof bij atmosferische druk en 20 ° C. Speciaal geïsoleerde tanks worden gebruikt voor vloeibare zuurstof opslag. De tanks worden buiten ziekenhuizen en andere instellingen staan geplaatst. Vloeibare zuurstof wordt door warmtewisselaars omgezet in gas voordat het in een ziekenhuis binnenkomt. Zuurstof wordt ook opgeslagen in kleinere cilinders met daarin gecomprimeerd gas; handig bij draagbare medische toepassingen en autogeen lassen en snijden.Toepassingen
Medisch
Zuurstof wordt gebruikt in de geneeskunde. Behandeling verhoogt niet alleen zuurstofgehalte in het bloed van de patiënt, maar heeft het neveneffect van afnemende weerstand tegen de bloedstroom in vele soorten zieke longen, verlichten belasting van het hart. Zuurstof therapie wordt gebruikt om emfyseem, longontsteking te behandelen, sommige hartaandoeningen, een aantal aandoeningen die leiden tot verhoogde bloeddruk in de longslagader. Behandelingen van de patiënt thuis is mogelijk geworden door draagbare apparaten. en zuurstof tenten zijn grotendeels vervangen door zuurstofmaskers. Denk ook aan "life support" systemen in vliegtuigen, onderzeeërs, ruimtevaartuigen en diepzeeduikers.Industrieel
Meest geproduceerde O2 wordt gebruikt om ijzer te smelten en om te zetten in staal. Smelten van ijzererts tot staal verbruikt 55% van het geproduceerde zuurstof. Daarbij wordt O2 geïnjecteerd met een hogedruklans in gesmolten ijzer, waardoor zwavel en andere verontreinigingen worden verwijderd, en bovendien de overmaat aan koolstof en de oxiden SO2 en CO2. Verder wordt zuurstof gebruikt voor "metaal snijden" en lassen, als oxidatiemiddel in raketbrandstof en in waterbehandeling. Zuurstof wordt gebruikt voor de chemische industrie. bijvoorbeeld ethyleen wordt omgezet met O2 tot ethyleenoxide, die op zijn beurt wordt omgezet in ethyleenglycol, grondmateriaal voor een groot aantal producten, waaronder antivries en polyester polymeren.Verbindingen
Oxiden en andere anorganische verbindingen
Water (H2O) een oxide van waterstof, waarin waterstofatomen covalent zijn gebonden aan zuurstof. Zuurstof is in de atmosfeer aanwezig in de vorm van sporen kooldioxide (CO2). De aardkorst gesteente bestaat grotendeels uit oxiden van silicium (SiO2, aluminium (aluminiumoxide Al2O3, in bauxite en korund), ijzer (ijzer (III) oxide Fe2O3, in hematiet en calciumcarbonaat (kalksteen).De rest van de aardkorst is ook deels gemaakt van zuurstofverbindingen, in het bijzonder diverse complexe silicaten.Wateroplosbare silicaten in de vorm van Na4SiO4, Na2SiO3, en Na2Si2O5 worden gebruikt als reinigingsmiddelen en als kleefstoffen.
Organische verbindingen en biomoleculen
- Zuurstof reageert spontaan met veel organische verbindingen.
- Zuurstof vertegenwoordigt meer dan 40% van de moleculaire massa van het ATP-molecuul. Adenosinetrifosfaat of ATP is een molecuul die in de celstofwisseling een sleutelrol vervult als drager van chemische energie.
- Tot de belangrijkste klassen van organische verbindingen die zuurstof bevatten behoren (waarin "R" een organische groep): alcoholen (R-OH), ethers (ROR); ketonen (R-CO-R), aldehyden (R-CO-H); carbonzuren (R-COOH); esters (R-COO-R); zuuranhydriden (R-CO-O-CO-R); en amiden (R-C (O) -NR2).
- Er zijn vele belangrijke biologische oplosmiddelen die zuurstof bevatten, zoals: aceton, methanol, ethanol, isopropanol, furan, THF, diethylether, dioxan, ethylacetaat, DMF, DMSO, azijnzuur en mierenzuur. Aceton ((CH3) 2CO) en fenol (C6H5OH) gebruikt als feeder materialen in de synthese van vele verschillende stoffen.
- Andere belangrijke organische verbindingen die zuurstof bevatten, zijn: glycerol, formaldehyde, glutaaraldehyde, citroenzuur, azijnzuuranhydride en aceetamide.
 Gevaar teken voor sterk oxiderende stoffen / Bron: Publiek domein, Wikimedia Commons (PD)
Gevaar teken voor sterk oxiderende stoffen / Bron: Publiek domein, Wikimedia Commons (PD)Verbranding en andere gevaren
Sterk geconcentreerde bronnen van zuurstof leiden tot snelle verbranding. Brand en explosie gevaren bestaan wanneer geconcentreerde oxidanten en brandstoffen in de nabijheid worden gebracht; echter, een ontsteking gebeurtenis, zoals warmte of een vonk, nodig om verbranding veroorzaken. Zuurstof zelf is niet de brandstof, maar het oxidatiemiddel. De behandeling van geconcentreerd zuurstof vereist een speciale opleiding om ervoor te zorgen dat ontstekingsbronnen worden geminimaliseerd.Toxiciteit van zuurstof
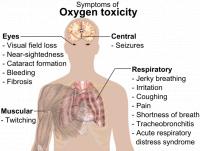
Zuurstofvergiftiging treedt op wanneer de longen zuurstof opnemen met een partiële druk 2 1/2 hoger dan normaal, zoals kan optreden bij diepzeeduiken.Ademhaling zuivere O2 in ruimtevaart, zoals in ruimtevaartpakken veroorzaakt geen schade vanwege de lage druk. Bij ruimtepakken is de partiële druk in het ademgas ongeveer 30 kPa (1,4 maal normaal), de resulterende partiële zuurstof druk in het bloed van de astronaut is weinig meer dan op normaal zeeniveau.
 Bron: Mikael Häggström, Wikimedia Commons (Publiek domein)
Bron: Mikael Häggström, Wikimedia Commons (Publiek domein)© 2015 - 2024 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
 Thulium: Het elementIn 1879 is thulium ontdekt door de Zweed Per Teodor Cleve tijdens bestuderen van onzuiverheden in lanthanide-oxiden. Na…
Thulium: Het elementIn 1879 is thulium ontdekt door de Zweed Per Teodor Cleve tijdens bestuderen van onzuiverheden in lanthanide-oxiden. Na…
 Mendelevium: Het elementMendelevium is een synthetisch element met chemisch symbool Md en atoomnummer 101. Een metalen radioactieve transuranic…
Mendelevium: Het elementMendelevium is een synthetisch element met chemisch symbool Md en atoomnummer 101. Een metalen radioactieve transuranic…
 Lawrencium: Het elementLawrencium is een synthetisch chemisch element met een chemisch symbool Lr en atoomnummer 103. Het is een radioactief me…
Lawrencium: Het elementLawrencium is een synthetisch chemisch element met een chemisch symbool Lr en atoomnummer 103. Het is een radioactief me…
 Het Magnuseffect bij balsportenEen hoekschop in het voetbal wordt algemeen beschouwd als een ideale gelegenheid om een doelpunt te maken. Meestal wordt…
Het Magnuseffect bij balsportenEen hoekschop in het voetbal wordt algemeen beschouwd als een ideale gelegenheid om een doelpunt te maken. Meestal wordt…
 Stikstof: Het elementStikstof is een chemisch element met symbool N en atoomnummer 7. Het is een transparant tweeatomig gas en het lichtste e…
Stikstof: Het elementStikstof is een chemisch element met symbool N en atoomnummer 7. Het is een transparant tweeatomig gas en het lichtste e…
Gerelateerde artikelen
Bronnen en referenties
- http://en.wikipedia.org/wiki/Oxygen
- http://woordenkracht.com/categorie/familie/grote-oxygenatie-event.php
- http://sciencenotes.org/?attachment_id=286
- http://www.visionair.nl/wetenschap/het-periodiek-systeem-waterstof-h-nr-1-van-118/
- http://www.business2community.com/leadership/oxygen-how-is-your-corporate-culture-breathing-part-1-0281480
- http://www.knmi.nl/cms/content/100061/twintig_vragen_en_antwoorden_over_de_ozonlaag
- Afbeelding bron 1: Publiek domein, Wikimedia Commons (PD)
- Afbeelding bron 2: Cepheus, Wikimedia Commons (Publiek domein)
- Afbeelding bron 3: Publiek domein, Wikimedia Commons (PD)
- Afbeelding bron 4: Mikael Häggström, Wikimedia Commons (Publiek domein)
Custor (173 artikelen)
Laatste update: 22-02-2017
Rubriek: Wetenschap
Subrubriek: Natuurkunde
Bronnen en referenties: 10
Laatste update: 22-02-2017
Rubriek: Wetenschap
Subrubriek: Natuurkunde
Bronnen en referenties: 10
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.