Lithium: Het element
 Lithium is het lichtste metaal, een zacht zilverachtig metaal dat aan de lucht snel oxideert. Ook met water reageert het krachtig onder vrijkomen van waterstof. De reactiviteit van lithium met water is zo heftig dat het is gebruikt voor het aandrijven van torpedo’s. Pas in 1923 is lithium voor het eerst op commerciële schaal geproduceerd. Lithium, een alkalimetaal, komt in de natuur voor als mengsel van de isotopen Li-6 en Li-7. Het is zo overvloedig aanwezig dat het nog beschikbaar is als de zon sterft en wij de aarde hebben verlaten, m.b.v. deze energiebron.
Lithium is het lichtste metaal, een zacht zilverachtig metaal dat aan de lucht snel oxideert. Ook met water reageert het krachtig onder vrijkomen van waterstof. De reactiviteit van lithium met water is zo heftig dat het is gebruikt voor het aandrijven van torpedo’s. Pas in 1923 is lithium voor het eerst op commerciële schaal geproduceerd. Lithium, een alkalimetaal, komt in de natuur voor als mengsel van de isotopen Li-6 en Li-7. Het is zo overvloedig aanwezig dat het nog beschikbaar is als de zon sterft en wij de aarde hebben verlaten, m.b.v. deze energiebron.
Intrinsieke eigenschappen Lithium
Algemeen
| naam | symbool | atoomnummer | groep | periode | blok | reeks | kleur |
|---|---|---|---|---|---|---|---|
| lithium | Li | 3 | alkalimetalen | 2 | S | alkalimetaal | zilver/wit |
Chemische eigenschappen
| atoommassa (u) | oxidatiestaten | electronegativiteit (Pauling) | atoomstraal (pm) | ionisatie potentiaal KJ/mol |
|---|---|---|---|---|
| 6,94 | +1 | 1,0 | 152 | 1ste 520 2de 7298 3de 11815 |
Fysische eigenschappen
| dicht- heid g/cm3 | hard- heid Mohs | smelt- punt °C | kook- punt C | aggregatie- staat 20°C | smelt- warmte KJ/mol | verdampings- warmte KJ/mol | kristal- structuur | specifieke warmte J/kg.°C | warmte- geleiding W/m°C |
|---|---|---|---|---|---|---|---|---|---|
| 0,534 | 0,6 | 180 | 1342 | vast | 3,0 | 148 | kubisch | 3600 | 85 |
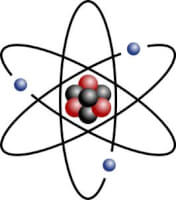 Het Lithiumatoom / Bron: Indolences / Rainer Klute, Wikimedia Commons (CC BY-SA-3.0)
Het Lithiumatoom / Bron: Indolences / Rainer Klute, Wikimedia Commons (CC BY-SA-3.0)Voorkomen van Lithium
Het element komt voor in bepaalde gesteenten en in het water van sommige bronnen. De mineralen lepidoliet, spodumeen, petaliet en amblygoniet zijn lithiumhoudende ertsen. De belangrijkste producent is Chili. De totale wereldreserve aan lithium is circa 28 miljoen ton; het jaarlijkse verbruik is circa 16.000, we kunnen dus zo’n 1000 jaar vooruit.Winning van Lithium
De erts spodumeen, LiAl (SiO3)2 wordt gemengd met verwarmd zwavelzuur; er vormt zich lithiumsulfaat Li2 SO4. Dat wordt gewassen met natriumcarbonaat Na2 CO3 volgens:Li2 SO4 + Na2 CO3 → Na2 SO4 + Li2 CO3 (vast)
Reactie van lithiumcarbonaat met zoutzuur HCl:
Li2 CO3 + 2HCl → 2LiCl + CO2 + H2O
Elektrolyse: gesmolten mengsel (430°C) van LiCl (55%) en KCl °C:
kathode: Li (+) + e(-) → Li (liq)
anode: Cl (-) → 1 / 2 Cl 2 (gas) + e(-)
Gebruikerseigenschappen
- Lithium is een licht zacht en reactief metaal dat niet als constructiemateriaal gebruikt wordt.
- Bijzondere eigenschappen van lithium zijn de hoge soortelijke warmte, de hoge thermische geleidbaarheid en de zeer lage dichtheid die de helft van water bedraagt.
- Lithium neemt deel aan een groot aantal chemische reacties, met organische- en anorganische stoffen.
- Het reageert met zuurstof tot monoxide en peroxide.
- Het is het enige alkalimetaal dat met stikstof reageert bij kamertemperatuur.
- Het reageert makkelijk met waterstof bij temperaturen van 500ºC, tot lithiumhydride.
- Lithium in metaalvorm reageert heftig met water.
- Lithium reageert met koolstof en halogenen en vormt met deze laatsten verbindingen die licht uitzenden.
 Bron: Claus Ableiter, Wikimedia Commons (GFDL)
Bron: Claus Ableiter, Wikimedia Commons (GFDL) Bron: RudolfSimon, Wikimedia Commons (CC BY-SA-3.0)
Bron: RudolfSimon, Wikimedia Commons (CC BY-SA-3.0) Bron: M.Minderhoud, Wikimedia Commons (CC BY-SA-3.0)
Bron: M.Minderhoud, Wikimedia Commons (CC BY-SA-3.0)Toepassingen van Lithium
- Lithium is legeringselementv(spoorelement) in aluminium en magnesium legeringen.
- Bij de vervaardiging van glas, keramiek porselein, o.a. om de helderheid en witheid te verbeteren. Ook wordt het als toevoeging bij cement gebruikt, zodat het sneller droogt.
- Lithiumcarbonaat is een geneesmiddel bij debipolaire stoornis (manisch-depressieve psychose). Het gaat de verschijnselen van manie tegen en stabiliseert de stemming. Lithiumcarbonaat (Li2CO3) kan worden toegepast in de manische fase, maar een belangrijke toepassing is eveneens het voorkomen van manische en depressieve fasen.
- Lithium reageert met acetyleen verbindingen tot lithium-acethyluren gebruikt voor vitamine A aanmaak.
- Belangrijke lithium verbinding is lithium-hydroxide, het witte poeder monohydraat-lithium-hydroxide.
- Lithiumbromide en -chloride vormen allebei een hars die vocht absorbeert en worden gebruikt in de airconditioning.
- Belangrijke industriële toepassing van lithium is in stearaatvorm als smeerolie verdikker.
- Gebruikt in alkaline batterijen.
- Bij verschillende laswerkzaamheden.
- Deuterium en lithium toepassing als brandstof. Om een elektriciteitscentrale van 1000 MW een jaar lang te laten draaien is 250 kg deuterium-tritium nodig.
- Deuterium is het niet-radioactieve isotoop van waterstof. Circa 0,015% van alle waterstof op aarde is deuterium; een liter water bevat circa 30 milligram. Dat maakt deuterium zeer overvloedig beschikbaar, de hoeveelheid deuterium in de oceanen is circa 4,5 x 10↑13 ton. O.a.gewonnen via elektrolyse van water. Zwaar water elektrolyseert moeilijker en blijft dus achter bij de elektrolyse en kan geisoleerd worden. De verbranding van deuterium-tritium levert een energie van 350 x 1015 Joule per ton op. Het deuterium aanwezig in zeewater is voldoende voor veertig miljard jaar energie, de zon brandt nog hooguit 5 miljard jaar.
- In de kernfusie centrale is lithium aanwezig in een mantel rond het plasma, waar het bestraald wordt met de neutronen uit de fusiereactie tot tritium. Het radioactieve tritium wordt in de fusiecentrale gemaakt en gelijk als brandstof gebruikt. Aangevoerde brandstoffen zijn deuterium en lithium, er vindt geen transport plaats van radioactieve brandstof.
- Lithium wordt toegepast voor warmte uitwisseling, wegens zijn grote specifieke warmte.
- Het Li+ ion is zeer klein. Bij vaste stoffen met een gelaagde structuur kan het ion tussen de lagen kruipen. Deze interkalaten zijn bruikbaar voor de fabricage van droge batterijen.
- Lithium heeft een hoge elektrochemische potentiaal. Het metaal wordt gebruikt in de organische synthese.
- De halogeniden, zoals lithiumchloride en lithiumbromide zijn hygroscopisch en worden als droogmiddel gebruikt.
- Het stearaat is een veelgebruikt smeermiddel bij hoge temperaturen.
- Lithium wordt toegevoegd aan speciale glassoorten, zoals glas voor telescoopspiegels. Ook wordt het toegevoegd aan glas om het hittebestendig te maken.
- De reactiviteit van lithium met water wordt wel gebruikt als energiebron voor het aandrijven van een torpedo.
Lithium, milieu en gezondheid
- Effecten korte blootstelling: Inademing: brandend gevoel, kuchen, kortademigheid, hijgen, keelpijn, kan longoedeem veroorzaken. Huid: roodheid, verbandingen, pijn, blaren. Ogen: roodheid, pijn, pijnlijke verbrandingen. Inslikken: maagkrampen, maagpijn, brandend gevoel, misselijkheid, shock of flauwvallen, overgeven, verzwakking.
- Lithium in metaalvorm reageert met stikstof, zuurstof en waterdamp in de lucht. Het lithium oppervlak wordt bedekt met een mengsel van lithium hydroxide (LiOH), lithium carbonaat (Li2CO3) en lithium nitride (Li3N). Lithium hydroxide is agressief corrosief.
- Verhitting veroorzaakt ontbranding en explosie, met toxische dampen. Het kan in poedervorm bij kamertemperatuur spontaan ontbranden in contact met lucht.
- Reageert agressief (brand en explosie) met sterke oxidatoren, zuren en veel andere verbindingen zoals halogenen, koolwaterstoffen, asbest en zand.
- Reageert agressief met water waarbij de licht ontvlambaar waterstofgas ontstaat en de corrosieve damp lithiumoxide. Waterorganismen kunnen hier zwaar onder lijden.
© 2013 - 2024 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Beleggen in lithiumEr is een toenemende vraag naar lithium. Dat maakt het lithium tot een interessante belegging. Er is sprake van een toen…
Beleggen in lithiumEr is een toenemende vraag naar lithium. Dat maakt het lithium tot een interessante belegging. Er is sprake van een toen…
 Lithium: Gebruik en bijwerkingenLithium is een medicijn met een antidepressieve en antimanische werking. Het behoort tot de groep stemmingstabilisatoren…
Lithium: Gebruik en bijwerkingenLithium is een medicijn met een antidepressieve en antimanische werking. Het behoort tot de groep stemmingstabilisatoren…
 StemmingsstabilisatorenStemmingsstabilisatoren zijn medicijnen die de stemming gelijkmatiger maken. Om deze reden worden stemmingsstabilisatore…
StemmingsstabilisatorenStemmingsstabilisatoren zijn medicijnen die de stemming gelijkmatiger maken. Om deze reden worden stemmingsstabilisatore…
 Cesium: Het elementCesium (Cs) is een zilver/goudkleurig, zacht en kneedbaar metaal dat voorkomt als stabiel (niet-radioactief) en als inst…
Cesium: Het elementCesium (Cs) is een zilver/goudkleurig, zacht en kneedbaar metaal dat voorkomt als stabiel (niet-radioactief) en als inst…
Gerelateerde artikelen
Li-ion technologie voor trapondersteuning elektrische fietsElektrische fietsen zijn tegenwoordig in vele merken verkrijgbaar en in alle prijsklassen. Maar uiteraard altijd nog duu…
Toxische zware metalenIn de natuur komen giftige planten, dieren en bacteriën voor. Sommige diersoorten gebruiken gif om een prooi te kunnen v…
Bronnen en referenties
- http://arch1design.com/blog/lithium/
- http://www.lenntech.nl/periodiek/elementen/li.htm#ixzz2XnF2RtVx
- http://nl.wikipedia.org/wiki/Lithium
- http://www.webelements.com/lithium/
- http://www.energieplatform.nl/energieopties/kernfusie/achtergrond/techniek/de-brandstof-deuterium-en-lithium/
- http://www.environmentalgraffiti.com/energy/news-environmentally-rechargeable-lithium-iron-battery/
- http://managing21.skynetblogs.be/archive/2008/11/12/lithium-tekort-loert-nu-al-achter-de-hoek.html
- Afbeelding bron 1: Indolences / Rainer Klute, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 2: Claus Ableiter, Wikimedia Commons (GFDL)
- Afbeelding bron 3: RudolfSimon, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 4: M.Minderhoud, Wikimedia Commons (CC BY-SA-3.0)
Custor (173 artikelen)
Laatste update: 20-02-2017
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 11
Laatste update: 20-02-2017
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 11
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.