Cesium: Het element
 Cesium (Cs) is een zilver/goudkleurig, zacht en kneedbaar metaal dat voorkomt als stabiel (niet-radioactief) en als instabiele (radioactief) element. De meest voorkomende radioactieve vorm is cesium-137. Het is als kwik vloeibaar bij kamertemperatuur. Cesium is ontdekt door Robert W Bunsen en Gustav R Kirchhoff in 1860 in mineraalwater. Identificatie was gebaseerd op twee heldere blauwe spectraallijnen die het metaal ook zijn naam gaven. (Latijn "caesius" dat hemels blauw betekent). Cesium reageert met ijs bij temperaturen boven -116 °C. Toevoegen van cesium aan water geeft een explosieve reactie, waarbij corrosief cesiumhydroxide (CsOH) wordt gevormd, een sterke base die glas corrodeert.
Cesium (Cs) is een zilver/goudkleurig, zacht en kneedbaar metaal dat voorkomt als stabiel (niet-radioactief) en als instabiele (radioactief) element. De meest voorkomende radioactieve vorm is cesium-137. Het is als kwik vloeibaar bij kamertemperatuur. Cesium is ontdekt door Robert W Bunsen en Gustav R Kirchhoff in 1860 in mineraalwater. Identificatie was gebaseerd op twee heldere blauwe spectraallijnen die het metaal ook zijn naam gaven. (Latijn "caesius" dat hemels blauw betekent). Cesium reageert met ijs bij temperaturen boven -116 °C. Toevoegen van cesium aan water geeft een explosieve reactie, waarbij corrosief cesiumhydroxide (CsOH) wordt gevormd, een sterke base die glas corrodeert.
Eigenschappen van het element Cesium
 Periodieksysteem. Cecium atoomnummer 55 / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
Periodieksysteem. Cecium atoomnummer 55 / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0) Cesium in een dichte glazen buis / Bron: Dnn87 Contact email: Dnn87yahoo.dk, Wikimedia Commons (CC BY-SA-3.0)
Cesium in een dichte glazen buis / Bron: Dnn87 Contact email: Dnn87yahoo.dk, Wikimedia Commons (CC BY-SA-3.0)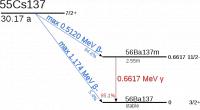 Verval van Cesium 137 in Barium / Bron: Tubas-en, Wikimedia Commons (Publiek domein)
Verval van Cesium 137 in Barium / Bron: Tubas-en, Wikimedia Commons (Publiek domein)| Naam | Symbool | Atoomnummer | Groep | Periode | Blok | Reeks | kleur |
|---|---|---|---|---|---|---|---|
| Cesium | Cs | 55 | Alkalimetalen | 6 | S | Alkalimetalen: lithium, natrium, kalium, rubidium, cesium, francium | zilver/goud kleurig |
Chemische eigenschappen
| Atoommassa (u) | Elektronenconfiguratie | Oxidatiestaten | Elektronegativiteit Pauling | Atoomstraal pm | Ionisatiepotentiaal KJ/mol |
|---|---|---|---|---|---|
| 132,91 | [Xe]6s1 | +1 | 0,79 | 265 | 1ste 375,7 2de 2234,4 |
Fysische eigenschappen
| Dicht- heid g/cm3 | Hard- heid Mohs | Smelt punt °C | Kook- punt °C | Smelt- warmte KJ/mol | Verdamp- ings- warmte KJ/mol | Kristal- structuur | Speci- fieke- warmte J/kg.°C | Elek- trische- weerstand microhm.cm | Warmte- geleiding W/m.°C | Aggre- gatie- staat 20°C |
|---|---|---|---|---|---|---|---|---|---|---|
| 1,87 | 0,2 | 28,4°C | 671 °C | 2,09 | 67,75 | Kubisch | 240 | 20 | 36 | Vloeibaar |
Ionisatieenergie
Ionisatie energy is de minimaal vereiste energie om een elektron uit het atoom in zijn grondtoestand vrij te maken in de gasfase.De millirem ( "mrem")
De millirem is de eenheid om het stralings-effect op de mens te meten:| Aktiviteit | sigaret roken | X thorax | TV kijken | Een gemiddelde levensjaar |
|---|---|---|---|---|
| Dosis straling in mRem | 14 | 10-20 | 0,5-1 | 360 |
Isotopen
Er zijn van het element cesium 34 isotopen bekend, meer dan van andere elementen. In de natuur komt één stabiele isotoop voor namelijk 133Cs. Cesium erts Pollucite - klikken voor de dia / Bron: Rob Lavinsky, Wikimedia Commons (CC BY-SA-3.0)
Cesium erts Pollucite - klikken voor de dia / Bron: Rob Lavinsky, Wikimedia Commons (CC BY-SA-3.0)Winning
Radioactieve cesium 137 komt voor in verschillende mineralen en het wordt door de mens geproduceerd wanneer uranium en plutonium neutronen absorberen en kernsplijting optreedt. (nucleaire reactoren en nucleaire wapens).Het mineraal polluciet is de belangrijkste bron van cesium, de grootste voorraad polluciet bevindt zich in Canada.
Cesium, gewonnen door elektrolyse van vloeibaar cesiumchloride (CsCl), lost op in de elektroliet (gesmolten zout).
kathode: Cs + (l) + e - → C's (l)
anode: Cl - (l) → 1 / 2 Cl 2 (g) + e -
Reactie van metallisch natrium met gesmolten cesium chloride.
Na + CsCI ⇌ Cs + NaCl
Gebruikerseigenschappen cesium 137
- Cesium is vloeibaar bij kamertemperatuur.
- Het reageert explosief met water, waarbij zich Cesiumhydroxide vormt.
- De halfwaardetijd van cesium-137 is 30 jaar. Het vervalt door emissie van beta- en gammastralen.
- Het reactieve Cesium wordt bewaard in inert gas of in vacuüm .
- De binding tussen het atoom zijn en valentie elektron is zwak en cesium verliest daardoor zijn buitenste elektron en wordt een Cs+ ion.
- In aanraking met water volgt een explosie volgens 2Cs + 2H2O → 2Cs+ + 2OH + H2 onder vorming van cesiumhydroxide en waterstof.
- Waarschuwing: Cesium is bijna tweemaal zo zwaar als water. Het metaal zinkt in water naar de bodem. De reactiewarmte door de reactie met water kan niet aan het water afgegeven worden wegens een omhullende waterstof bel. Het cesium wordt heet en door temperatuur verschil tussen cesium en de glazen bodem van een reageerkolf springt het glas stuk en volgt alsnog de explosie door contact van cesium met water en lucht.
- Het hydroxide vormt een base die in staat is glas te corroderen en te etsen.
- Cesium oxideert in lucht onder vorming van oxide Cs2O en peroxiden (Cs2O2, Cs2O3).
Toepassingen
- Cesium wordt toegepast in atoomklokken. Sinds 1967 wordt de seconde gedefinieerd als 9.192.631.770 cycli van de straling bij de overgang tussen twee energietoestanden van de isotoop Cesium 133 (bij het absolute nulpunt van 0 graden Kelvin).
- Cesiumformiaat wordt gebruikt bij olieboringen. Bij olie boren wordt veel puin van gesteente opgepompt en dat is makkelijker met een zware vloeistof. De soortelike gewicht (dichtheid) van cesiumformiaat oplossingen is het dubbele van water.
- In vocht-density meters voor gebouwen en huizen.
- In de industrie om vloeistofstromen in leidingen te detecteren.
- Diktemeters voor het meten van de dikte van plaatwerk, papier, film etc.
- Cesium-137 wordt gebruikt in medische therapie o.a. om kanker te behandelen.
Milieu en gezondheid
Gezondheid
- Iedereen is blootgesteld aan kleine hoeveelheden cesium-137 in bodem en water als gevolg van atmosferische neerslag.
- Mensen krijgen sporen cesium binnen door inademen, drinken of eten.
- In de atmosfeer het cesiumniveau laag.
- De hoeveelheid cesium in voedsel en water is afhankelijk van de emissie van radioactief cesium door o.a. kerncentrales, en nucleaire proeven.
- Cesium vormt geen gevaar voor de volksgezondheid. Als een individu door een ongeval in contact komt met radioactief cesium, kunnen door straling van alfa deeltjes en gamma straling cellen beschadigd raken. De symptomen zijn: misselijkheid, overgeven, diarree en bloedingen. Als men voor lange tijd blootgesteld wordt aan cesium, kan men het bewustzijn verliezen, in coma raken en sterven.
Milieu
- Cesium komt in de natuur terecht door erosie van gesteenten.
- Radioactieve cesium isotopen kunnen vrijkomen in de lucht door ongelukken in kerncentrales en bij het testen van kernwapens,
- deze radioactieve isotopen nemen door radioactief verval relatief snel in concentratie af.
- Cesium verplaatst zich door de lucht. In de bodem lossen veel cesiumverbindingen op in water en zwermt niet uit naar het grondwater, het bindt zich aan bodemdeeltjes, er is beperkt contact met plantenwortels.
- Radioactief cesium kan planten binnendringen als neerslag.
- Dieren die blootgesteld zijn aan hoge doses cesium, vertonen gedragsverandering.
- Ziekenhuizen en laboratoria genereren cesium-137 afval, dat komt niet in het milieu terecht, maar de besmette metalen instrumenten kunnen als schrot in de recycling terecht komen en milieuverontreiniging veroorzaken.
- Cesium-137 ondergaat radioactief verval met de uitstoot van beta-deeltjes en gammastralen en vervalt tot radioactief barium, dat vervalt tot niet-radioactief barium.
- De halfwaardetijd van cesium-137 is relatief kort namelijk 30 jaar.
- Jaarlijkse blootstelling van de mens aan cesium-137 in verband met atmosferische neerslag is minder dan 1 mrem.
- Blootstelling aan straling van cesium-137 resulteert in een verhoogd risico op kanker.
- We nemen cesium-137 in met voedsel en water, of ademen het in als stof. Het wordt in een hogere concentratie opgeslagen in spieren dan in bot en vet.
- Het blijft relatief kort in het lichaam, het wordt uitgescheiden via de urine.
- Tests meten de hoeveelheid radionucliden in urine en met instrumenten de gammastralen van cesium-137 in het lichaam.
© 2013 - 2024 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Radioactief besmet voedselHet eten van radioactief besmet voedsel na een kernramp kan leiden tot acute gezondheidsproblemen. Omdat overheden daar…
Radioactief besmet voedselHet eten van radioactief besmet voedsel na een kernramp kan leiden tot acute gezondheidsproblemen. Omdat overheden daar…
 Kernramp: wat doen we bij nuclair ongeval?De nucleaire ramp in de kerncentrales van het Japanse Fukushima, doet ook bij onze de ongerustheid over de veiligheid va…
Kernramp: wat doen we bij nuclair ongeval?De nucleaire ramp in de kerncentrales van het Japanse Fukushima, doet ook bij onze de ongerustheid over de veiligheid va…
 Radioactiviteit en de mensMen spreekt van radioactieve stralen (radio=straling), dit moet ioniserende straling zijn, niet de straling is radioacti…
Radioactiviteit en de mensMen spreekt van radioactieve stralen (radio=straling), dit moet ioniserende straling zijn, niet de straling is radioacti…
 Silicium: Het elementSilicium is een donkergrijs broze metalloïde.Het is meestal vierwaardig maar kan ook tweewaardig zijn. Silicium dioxide(…
Silicium: Het elementSilicium is een donkergrijs broze metalloïde.Het is meestal vierwaardig maar kan ook tweewaardig zijn. Silicium dioxide(…
 Lithium: Het elementLithium is het lichtste metaal, een zacht zilverachtig metaal dat aan de lucht snel oxideert. Ook met water reageert het…
Lithium: Het elementLithium is het lichtste metaal, een zacht zilverachtig metaal dat aan de lucht snel oxideert. Ook met water reageert het…
Gerelateerde artikelen
De eigenschappen van metalen verklaard door de metaalbindingHet grootste gedeelte van het periodieke systeem der elementen bestaat uit metalen. Opvallend aan metalen is dat ze in z…
Bronnen en referenties
- http://www.epa.gov/radiation/radionuclides/cesium.html
- http://www.lenntech.nl/periodiek/elementen/cs.htm
- http://dwb4.unl.edu/Chem/CHEM869Z/CHEM869ZMats/ARDC/mrem.html
- http://nl.wikipedia.org/wiki/Cesium
- http://sciencenotes.org/?attachment_id=341(afbeelding: yttrium embleem)
- http://prospect.rsc.org/blogs/cw/2010/05/11/chemistry-worlds-favourite-chemistry-things/(foto cesium explosie in contact met water en lucht)
- http://www.irocks.com/render.html?species=Pollucite (foto cesium erts Pollucite)
- Afbeelding bron 1: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 2: Dnn87 Contact email: Dnn87yahoo.dk, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 3: Tubas-en, Wikimedia Commons (Publiek domein)
- Afbeelding bron 4: Rob Lavinsky, Wikimedia Commons (CC BY-SA-3.0)
Custor (173 artikelen)
Laatste update: 13-12-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 11
Laatste update: 13-12-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 11
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.