Goud: Het element
 Het symbool voor goud 'Au' komt van 'Aurum', Latijns voor goud. Zijn goede koudvervormbaarheid, elektrische geleidbaarheid, en corrosievastheid hebben geleid tot vele toepassingen zoals munten, juwelen, medailles, goldplating, tandheelkunde, geneeskunde, elektrische bedrading, gekleurd glas, bladgoud enz. Omdat goud tot de zwaarste metalen behoort is bij het ontstaan van het zonnestelsel het grootste deel diep in de toen vloeibare aarde gezonken. Het goud wat in de aardmantel gevonden wordt is gevolg van meteoor regens van de afgelopen 3,5 miljard jaar.
Het symbool voor goud 'Au' komt van 'Aurum', Latijns voor goud. Zijn goede koudvervormbaarheid, elektrische geleidbaarheid, en corrosievastheid hebben geleid tot vele toepassingen zoals munten, juwelen, medailles, goldplating, tandheelkunde, geneeskunde, elektrische bedrading, gekleurd glas, bladgoud enz. Omdat goud tot de zwaarste metalen behoort is bij het ontstaan van het zonnestelsel het grootste deel diep in de toen vloeibare aarde gezonken. Het goud wat in de aardmantel gevonden wordt is gevolg van meteoor regens van de afgelopen 3,5 miljard jaar.
 Bron: Cepheus, Wikimedia Commons (Publiek domein)
Bron: Cepheus, Wikimedia Commons (Publiek domein)Plaats van elementair goud in het periodiek systeem
Goud is een scheikundig element met symbool Au en atoomnummer 79. Het is een helder gele, zachte, kneedbaar metaal. De eigenschappen en uiterlijk blijven onveranderd bij blootstelling aan lucht of water. Chemisch is goud een overgangsmetaal en behoort tot groep 11 van elementen in het periodiek systeem.Algemene eigenschappen van elementair goud
| Naam | Symbool | Atoomnummer | Groep | Periode | Blok | Reeks | Kleur |
|---|---|---|---|---|---|---|---|
| Goud | Au | 79 | Groep 11 | periode 6 | D-blok | Overgangsmetalen | Geel metalliek |
Chemische eigenschappen van elementair goud
| Atoom- massa (u) | Elektronen- configuratie | Oxidatie toestanden | Elektro- negativiteit (Pauling) | Atoomstraal (pm) | Ionisatie- potentiaal (KJ/mol) | Aggre- gatie- toestand (20 C) |
|---|---|---|---|---|---|---|
| 196,966569 | [Xe] f14 5d10 6s1? Per shell: 2, 8, 18, 32, 18, 1 | 5, 4, 3, 2, 1, −1 amphoterische oxide | 2,54 | Imperisch 136±6 Covalent 116 v/d Waals 144 | 1e 890 2e 1980 | Vast |
Fysische eigenschappen van elementair goud
| Dicht- heid (0 °C) (g/cm3) | Smelt- punt (K) | Kook- punt (K) | Smelt- warmte (KJ/mol) | verdampings warmte (KJ/mol) | Kristal structuur | warmte geleiding (W/m.K) | elektrische weerstand (nQ.m) | Magne tisme |
|---|---|---|---|---|---|---|---|---|
| 19,30 | 1064,18 °C 1337,33 K | 2970 °C 3243 K | 12.55 | 342 | Kubisch vlakken gecenterd KVC | 318 | 22,14 | Dia magnetisch |
Mechanische eigenschappen van elementair goud
| Elasticiteits modules (GPa) | Afschuif modules (GPa) | Trek- vastheid (GPa) | Bulk modules (GPa) | Poisson factor | Hardheid |
|---|---|---|---|---|---|
| 79 | 120? | 27 | 180 | 0,44 | Mohs: 2.5 Vickers: 216 MPa Brinell: 25 MPa |
Isotopen van goud
Goud heeft maar één stabiele isotoop, 197Au, die ook zijn enige natuurlijke isotoop is. Zesendertig isotopen zijn synthetisch, de stabielste daarvan is 195Au met een halveringstijd van 186,1 dagen. De minst stabiel is 171Au, die vervalt door proton emissie met een halfwaardetijd van 30 microseconden.De stabielste isotopen van goud
| Isotoop | NA(%) | Halveringstijd | Verval via | Vervalenergie(MeV) | Vervalproducten |
|---|---|---|---|---|---|
| 195Au | Synthetisch | 186 dagen | Epsilon | 0,227 | 195Pt |
| 196Au | Synthetisch | 6,183 dagen | Epsilon | 1,506 | 196Pt |
| 197Au | 100% | --- | alfa | 0,9545 | 193Ir |
| 198Au | Synthetisch | 2,695 dagen | beta | 1,372 | 198Hg |
| 199Au | Synthetisch | 3,169 dagen | β− | 0,453 | 199Hg |
 Goud voorraad / Bron: Agnico Eagle, Wikimedia Commons (CC0)
Goud voorraad / Bron: Agnico Eagle, Wikimedia Commons (CC0)Kenmerkende eigenschappen van goud
- Goud is de meest kneedbare van alle metalen; een enkele gram kan uitgewalst worden in een blad van 1 vierkante meter bladgoud, dun genoeg om transparant te zijn.
- Dergelijke semi-transparante plaat reflecteert infrarood licht, waardoor ze dienen als infrarood vensters in vizieren van hittebestendige pakken.
- Goud vormt legeringen met sommige andere metalen. Goud is een goede stroomgeleider en reflecteert infrarode stralen zeer sterk. Chemisch ongevoelig voor lucht, vocht en de meeste corrosieve stoffen, en daarom geschikt voor gebruik als muntstukken en juwelen en als beschermende laag (goldplating) op onedele metalen.
- Goud is echter niet honderd procent chemisch inert. Goud lost op in koningswater en in bijvoorbeeld natrium- of kaliumcyanide.
- Oxidatietoestanden van goud zijn: +1 en +2 resp. goud (I) en goud (III).
- Goud ionen in oplossing worden gemakkelijk gereduceerd. Het toegevoegde metaal wordt geoxideerd en lost op. het goud slaat neer als vast metaal. (vergulden)
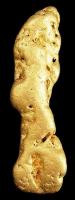 Grote goudklomp gevonden in Alaska, gewicht 77gram / Bron: Rob Lavinsky / iRocks.com, Wikimedia Commons (CC BY-SA-3.0)
Grote goudklomp gevonden in Alaska, gewicht 77gram / Bron: Rob Lavinsky / iRocks.com, Wikimedia Commons (CC BY-SA-3.0)Het voorkomen van goud op aarde
- Goud is een van de minst reactieve elementen. Het metaal wordt dan ook vaak gevonden in vrije elementaire vorm, zoals nuggets of korrels in alluviale afzettingen.
- Goud vormt ook verbindingen met het element zilver (Ag) waarmee het vaak natuurlijk is gelegeerd. Andere veel voorkomende natuurlijke goudlegeringen zijn met koper(Cu) en palladium (Pd).
- Goud is bestand tegen afzonderlijke zuren, maar lost op in nitro-hydrochloric-zuur ofwel koningswater. Goud lost ook op in alkalische oplossingen van cyanide, deze eigenschap wordt gebruikt in de goud winning. Het lost op in kwik, en vormt amalgaam legeringen. Het is onoplosbaar in nitric zuur, dat zilver en onedele metalen oplost, een eigenschap die lange tijd gebruikt is om de aanwezigheid van goud aan te tonen en het isoleren van goud.
- Omdat de Aarde was gesmolten in de beginfase is het meeste (zware)goud diep in de aarde gezonken Het grootste deel van het goud dat zich heden in de aardkorst bevindt is de laatse paar miljard jaar door meteorieten aangevoerd .
- Op Aarde, wordt goud gevonden in ertsen in rotsen gevormd in het Precambrium, meestal als metaal in een vaste oplossing met zilver (goud-zilver legering). Dergelijke legeringen hebben meestal een zilvergehalte van 8-10%.
- Electrum is goud met meer dan 20% zilver. De kleur loopt van goud-zilver naar zilverachtig, afhankelijk van het zilvergehalte. Hoe meer zilver, hoe lager de dichtheid.
- Goud komt op sommige plaatsen voor als kleine microscopische deeltjes ingebed in rots, vaak samen met kwarts of sulfide mineralen ("Fool's Gold", een pyriet). Het metaal in elementaire toestand wordt ook gevonden in de vorm van korrels of grotere nuggets die zijn geërodeerd uit rotsen en beland in slib van waterstromen. Deze 156-troy ounce (4,9 kg) nugget, bekend als de Mojave Nugget, werd gevonden door een goudzoeker in het Zuid-Californië woestijn.
- Goud komt soms voor in combinatie met tellurium in de mineralen calaverite, krennerite, nagyagite, petzite en Sylvanite, en als de zeldzame bismuthide maldonite (Au2Bi) en antimonide aurostibite (AuSb2). Goud komt ook voor bij zeldzame legeringen met koper, lood en kwik in de mineralen: sauricupride (Cu3Au), novodneprite (AuPb3) en weishanite ((Au, Ag) 3Hg2).
- De oceanen bevatten 10-30 gram goud per m3 dat houdt in 15000 ton totaal aan goud.
Productie van goud
Aan het eind van 2009 werd geschat dat al het goud ooit gedolven in totaal 165.000 ton. Dit kan worden voorgesteld door een kubus van 20x20x20 meter. Bij $50000 per kg zou 160.000 ton goud een waarde hebben van $ 800.000.000.0000 hebben (8 trillion). Wereldproductie voor 2011 bedroeg 2.700 ton. Toepassing van nieuw geproduceerd goud is ongeveer 50% in sieraden, 40% in opslag door investeerders en 10% in de industrie.Sinds 1880, is Zuid-Afrika de grootste goud leverancier ter wereld, ongeveer 50% van het goud ooit geproduceerd komt uit Zuid Afrika. De productie in 1970 is goed voor 79% van de wereld productie. In 2007 overtroefde China met ruim 250 ton Zuid-Afrika als grootste goudproducent. Vanaf 2013 is dus China de grootste goudproducent ter wereld, gevolgd door Australië, de Verenigde Staten, Rusland, Peru en Zuid-Afrika, andere belangrijke producenten zijn Ghana, Burkina Faso, Mali, Indonesië en Oezbekistan.
Heden is naar schatting 25% van de wereld goudproductie afkomstig van ambachtelijke, kleinschalige mijnbouw.
Extractie
Ertsgehalte van slechts 0,5 mg / kg kan al rendabel zijn. Typische erts kwaliteiten in open mijnen 1-5 mg / kg ; erts kwaliteiten in ondergrondse of hardrock mijnen zijn meestal minstens 3 mg / kg . Door ertsgehalte van 30 mg / kg (30 ppm) gewoonlijk nodig voordat goud zichtbaar is voor het blote oog, in de meeste goudmijnen is goud onzichtbaar. De gemiddelde goudwinning- en extractie kosten waren in 2007 circa USA $ 10.000/kg. Deze variëren, afhankelijk van het type mijnbouw en erts kwaliteit.Synthese van goud uit andere elementen.
Goud kan in een kernreactor worden vervaardigd door bestraling van platina of kwik. Kwik isotoop 196Hg, (0,15% in natuurlijke kwik), kan in goud 197Au worden omgezet door bestraling met langzame neutronen. Door neutron capture gevolgd door electron capture ontstaat 197Au.Toepassingen van goud
- Door de zachtheid van puur (24k) goud, wordt het gelegeerd met andere metalen om het voldoende sterkte te geven voor gebruik.
- Goudlegeringen van lager karaat, meestal 22k, 18k, 14k of 10k, bevatten hogere percentages koper of andere metalen zoals zilver of palladium in de legering. Koper is het meest gebruikte legeringselement, waardoor het goud een rode kleur krijgt.
- Veertien karaats goud-koperlegering bijna identieke kleur als brons. Blauw goud ontstaat door legeren met ijzer, het is brozer en moeilijker om te bewerken. Veertien en achttien-karaats goud door legering met zilver, heeft een groen-gele kleur en wordt wel “Het groene goud” genoemd.
- Witte goudlegeringen verkrijgt men door legeren met met palladium of met nikkel. Wit 18-karaats goud met 17,3% nikkel, 5,5% zink en 2,2% koper is zilverachtig. Hoog-karaat witgoud legeringen zijn veel beter bestand tegen corrosie dan de goud-nikkel legeringen.
Geneeskunde
- Goud is een van de vroegste medicijnen (bekend door de Griek Dioscorides arts in het leger van keizer Nero). De middeleeuwers zagen goud als gunstig voor de gezondheid. Sommige beoefenaren van moderne alternatieve geneeskunde dichten aan goud nog altijd een genezende kracht toe.
- Sommige goudzouten hebben ontsteking remmende eigenschappen en worden gebruikt in de behandeling van onder andere artritis. Goud injecties als een middel om de pijn van reumatoïde artritis te verminderen. Alleen zouten en radio-isotopen van goud zijn van geneeskundige waarde, elementair (metalliek) goud is te inert voor reacties.
- Goudlegeringen worden gebruikt in de tandheelkunde, zoals aanbrengen van kronen en bruggen. Het gebruik van gouden kronen en gouden snijtanden zijn in sommige culturen in de mode.
- Goud of legeringen van goud en palladium, worden toegepast als geleidende coating op biologische monsters en niet-geleidende materialen zoals kunststoffen en glas om te worden bekeken onder een elektronenmicroscoop. Het verbetert de kwaliteit van de beelden.
- Goud produceert ook een hoog rendement van secundaire elektronen bij bestraling met een elektronenbundel, en deze lage-energie-elektronen zijn de meest gebruikte signaalbron in elektronenmicroscoop scans.
- De isotoop goud-198 (halveringstijd 2,7 dagen) wordt gebruikt in de nucleaire geneeskunde, in sommige kankerbehandelingen.
Sieraden van goud
| Karaat goud | Gehalte aan goud % | Gehalte in decimalen | Keurmerk in goud geslagen |
|---|---|---|---|
| 24 | 100% | 0,999 | 999 |
| 22 | 91,6% | 0,916 | 916 |
| 20 | 83,3% | 0,833 | 833 |
| 18 | 75% | 0,75 | 750 |
| 14 | 58,3% | 0,583 | 583 |
- Goud soldeer wordt gebruikt voor het verbinden van de onderdelen van gouden sieraden door hardsolderen. Goudsoldeer moet passen bij het karaat van het werk. Goud soldeer wordt meestal gemaakt in ten minste drie soorten aangeduid als Makkelijk, Medium en Hard en dat heeft vooral met de smelttemperaturen maken.
- Via de vaste, hoge smeltpunt soldeer, gevolgd door soldeer met geleidelijk lagere smeltpunten, kan goudsmeden assembleren complexe onderdelen met verschillende afzonderlijke soldeerverbindingen.
- Goud kan worden gemaakt in draad en gebruikt in borduurwerk.
- Goldchloride oplossingen worden gebruikt om colloïdaal goud te maken. Goudchloride en goudoxide wordt gebruikt voor rood gekleurd glas.
Diversen
- In fotografie worden goud toners gebruikt om zwart wit prints van zilverbromide te verschuiven naar bruine of blauwe tonen.
- Goud is een goede reflector van elektromagnetische straling zowel infrarood, zichtbaar licht en radiogolven. Het wordt gebruikt voor de beschermende coatings op satellieten, infrarood beschermende fronten in thermische beveiliging pakken en helmen van astronauten.
- Goud kan zo dun worden vervaardigd dat het transparant wordt. En gebruikt bijvoorbeeld in cockpit ramen. Doorvoering van elektrische stroom zorgt voor voldoende warmte ontwikkeling om ijsafzetting te voorkomen.
Elektronica
- De concentratie van vrije elektronen in elementair goud is 5.90 x 10↑22/cm3. Goud heeft een groot elektrisch geleidingsvermogen.
- Goede geleidbaarheid en weerstand tegen oxidatie en corrosie heeft geleid tot het gebruik in het elektronische tijdperk, vaak als een dunne coating op elektrische connectoren. Zo wordt goud gebruikt in connectors van kostbare elektronica kabels, zoals audio, video en USB kabels.
- Echter, het gebruik van goud in andere toepassingen in elektronische sleepcontacten in zeer vochtige of corrosieve omgevingen, en in gebruik is voor de contacten met een zeer hoge mislukking kosten (sommige computers, communicatie-apparatuur, ruimtevaartuigen, vliegtuigen is) is heel gebruikelijk.
- Naast glijdende elektrische contacten, wordt goud ook gebruikt in elektrische schakel contacten vanwege zijn weerstand tegen corrosie, elektrische geleidbaarheid, ductiliteit en afwezigheid van toxiciteit. Schakelcontacten zijn meestal onderworpen aan intenser corrosie stress dan sleepcontacten.
- Fijne gouden draden worden gebruikt om halfgeleiders e.d aan te sluiten op hun omgeving door middel van een proces dat men wire bonding noemt.
- Goud lost op in alkalische oplossingen van kalium- of natriumcyanide, om het zout goudcyanide te vormen, dat is de elektrolyt die gebruikt wordt in het galvaniseren van goud op basismetalen (elektro-goldplating).
Invloed van goud op milieu en volksgezondheid
- Zuivere metalen (elementaire) goud is niet-toxisch en niet-irriterend bij inname. goud is een onderdeel van de alcoholische dranken Goldschlager, Gold Strike, en Goldwasser.
- Oplosbare verbindingen (goud zouten) zoals goud chloride zijn toxisch voor de lever en nieren. Cyanide zouten van goud zoals kaliumgoudcyanide, gebruikt bij goldplating (door galvaniseren), toxisch vanwege zowel hun cyanide en goudgehalte. Er zijn zeldzame gevallen van dodelijke goud vergiftiging door kaliumgoudcyanide.
- Goud productie wordt terecht geassocieerd met (gevaarlijke) vervuiling. Goud gemengd met natriumcyanide of kwik. Cyanide is een zeer giftige chemische stof die levende wezens kunnen doden wanneer ze worden blootgesteld aan kleine hoeveelheden. Cyanide lekken van goudmijnen hebben heeft zich reeds voorgedaan en die het leven in zee en rivieren hebben gedood en waren/zijn grote milieurampen.
- Dertig ton erts wordt gedumpt als afval voor de productie van één troy ounce (31,1gram) goud. Deze stortplaatsen zijn de bron van zware elementen zoals cadmium, lood, zink, koper, arsenicum, selenium en kwik. Wanneer sulfide dragende mineralen in deze stortplaatsen worden blootgesteld aan lucht en water, wordt de sulfide omgezet in zwavelzuur, die zware metalen oplost wat het lekken naar oppervlakte- en grondwater bevordert. (zuurdrainage). Deze gouderts stortplaatsen zijn op termijn zeer gevaarlijk.
- Goudwinning is zeer energie-intensief, de winning en verwerking van erts, vraagt 25 kWh elektriciteit per gram goud.
© 2014 - 2024 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Goud & wie in de wereld heeft het meeste goudGoud kan steeds meer waard worden door een toenemende vraag naar goud. Dat geldt voor uw gouden sieraad, maar ook voor d…
Goud & wie in de wereld heeft het meeste goudGoud kan steeds meer waard worden door een toenemende vraag naar goud. Dat geldt voor uw gouden sieraad, maar ook voor d…
 Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
 Het aantonen van goudGoud is te zacht voor het maken van bijvoorbeeld sieraden. Door te legeren met bepaalde elementen zoals zilver, platina,…
Het aantonen van goudGoud is te zacht voor het maken van bijvoorbeeld sieraden. Door te legeren met bepaalde elementen zoals zilver, platina,…
Gerelateerde artikelen
Goud en diamanten verkopen, hoe zit dat?Als je geld nodig hebt dan kun je goud verkopen. Gouden sieraden bevatten vaak echt goud en zijn soms veel geld waard. O…
Goud, wat is het?‘De koning der metalen’ wordt het wel genoemd, dit zachte, warm goudgele, glanzende materiaal, waar mensen al vele duize…
NanoFLOWCELL, zout als alternatief voor fossiele brandstofHet bedrijf NanoFLOWCELL AG heeft een krachtige nieuw redox flow accu ontwikkeld waarop een auto kan rijden. Het princip…
Bronnen en referenties
- http://www.richardvanhooijdonk.com/?attachment_id=3280(afbeelding gouden munten)
- http://radio.rtvkatwijk.nl/?page_id=45 (Afbeelding gouden baren)
- http://en.wikipedia.org/wiki/Gold
- http://www.dawsongold.nl/werkwijze/keurtekens-goud-en-zilver/(afbeelding keurtekens)
- http://www.inkoop-goud-rotterdam.nl/ (afbeeldingen sieraden)
- http://nl.wikipedia.org/wiki/Goud
- Afbeelding bron 1: Cepheus, Wikimedia Commons (Publiek domein)
- Afbeelding bron 2: Agnico Eagle, Wikimedia Commons (CC0)
- Afbeelding bron 3: Rob Lavinsky / iRocks.com, Wikimedia Commons (CC BY-SA-3.0)
Custor (173 artikelen)
Laatste update: 02-11-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 9
Laatste update: 02-11-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 9
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.