Energie in een reactie: endotherm & exotherm
 Rekenen bij een practicum is nog niet zo gemakkelijk als het lijkt, met mol rekenen lukt nog wel, maar dan komt de verdieping erbij. Dit geeft een heel nieuw zicht op de reactie wat weer allerlei nieuwe verklaringen met zich mee brengt. Of een reactie exotherm of endotherm is, maakt veel uit bij het uitreken van de energieopbrengst of -kosten. Voor energiebedrijven is het heel belangrijk om uit te kunnen rekenen hoeveel energie er vrij komt bij een reactie, zo kunnen ze kijken hoe ze het beste energie op kunnen wekken en wat in verhouding de goedkoopste en veiligste manier is.
Rekenen bij een practicum is nog niet zo gemakkelijk als het lijkt, met mol rekenen lukt nog wel, maar dan komt de verdieping erbij. Dit geeft een heel nieuw zicht op de reactie wat weer allerlei nieuwe verklaringen met zich mee brengt. Of een reactie exotherm of endotherm is, maakt veel uit bij het uitreken van de energieopbrengst of -kosten. Voor energiebedrijven is het heel belangrijk om uit te kunnen rekenen hoeveel energie er vrij komt bij een reactie, zo kunnen ze kijken hoe ze het beste energie op kunnen wekken en wat in verhouding de goedkoopste en veiligste manier is.
Het energie-effect
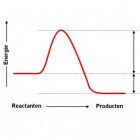
Bij elke reactie is er sprake van een energie-effect, want anders is er geen sprake van een reactie. Een reactie treedt pas op als atomen van plaats verwisselen er en nieuwe stoffen ontstaan. Om de atomen van plaats te laten verwisselen zul je eerst de beginproducten moeten ontleden, iets wat energie kost. Pas daarna kun je de nieuwe stoffen vormen, ook hierbij komt energie een rol spelen. Alle ontledingsreacties kosten energie, omdat je verbindingen moet verbreken. Bij vormingsreacties is er geen vaste regel, het verschilt per stof of er energie vrijkomt of dat het juist energie kost om het te vormen.De wet van behoud van energie
Om bepaalde reacties te kunnen begrijpen moet je de wet van energiebehoud kennen en snappen. De wet van behoud van energie is bijna hetzelfde als de wet van behoud van massa, het houdt in dat energie niet zomaar kan verdwijnen of er bij kan komen. Hiermee kun je onder andere verklaren dat de producten bij een exotherme of endotherme reactie meer of juist minder energie bevatten.Endotherm
Bij een endotherme reactie kost het energie om de reactie op gang te houden. Uiteindelijk zit er in de reactieproducten meer energie dan in de beginstoffen, want energie kan namelijk niet zomaar verdwijnen en gaat dus in de reactieproducten zitten. En de energie die vrijkomt door de reactie wordt niet aan de omgeving afgestaan, dus moet de vrijgekomen energie wel in de reactieproducten zitten, zie de wet van behoud van energie.Een voorbeeld
Als stoffen overgaan van een vaste fase naar een vloeibare fase kost dit energie, deze energie wordt dan ontrokken aan de omgeving. Dit is een endotherme reactie, omdat het de omgeving energie kost om de reactie in stand te houden. Dit is goed te zien aan het smelten van een ijsblokje in je drankje, je drankje wordt kouder en geeft dus energie af terwijl het ijsblokje smelt en energie in zich opneemt.Exotherm
Een exotherme reactie is het tegenovergestelde van een endotherme reactie, als de reactie eenmaal draait dan hoef je er geen energie meer in te steken en levert het ook energie, vaak in de vorm van warmte, op. Een goed voorbeeld van een exotherme reactie is verbranding, als hout eenmaal brandt dan blijft het branden zolang er genoeg brandstoffen aanwezig zijn, want zodra de brandstoffen op zijn kan het vuur nergens meer zijn energie vandaan halen en gaat het uit.Een voorbeeld
Een goed voorbeeld van een exotherme reactie die wordt gebruikt om energie op te wekken is kernsplijting. In kerncentrales wordt gebruik gemaakt van kernsplitsing om elektriciteit op te wekken. Als er eenmaal één uraniumkern is gespleten dan blijft de reactie doorgaan, de reactie is dus exotherm. Het is in dit geval zelfs zo erg dat als we de reactie onbeïnvloed laten verlopen dat dan de kerncentrale zou ontploffen.Rekenen met energie
Rekenen met energie is niet gemakkelijk, omdat je eerst de chemische hoeveelheden(aantal mol) moet bereken en daarna ook nog eens met grote aantallen joule moet rekenen. Voordat je begint met rekenen moet je de ontledingswarmten van de beginstoffen opzoeken en deze bij elkaar optellen, hierna zoek je de vormingswarmte op van de reactieproducten en ook deze tel je bij elkaar op.Het is mogelijk dat er aan beide kanten negatieve getallen uitkomen, let hier niet op en volg de rest van de stappen gewoon op. Aan het einde zul je zien waarom het mogelijk is. Nu ga je het verschil in energie voor- en na de pijl uitrekenen, dit doe je door: energie na de pijl(eind energie) - energie voor de pijl(begin energie) = d E.(delta energie = verschil in energie tussen begin en eind) Als d E negatief is dan komt er energie vrij, de reactie is dan exotherm. In dit geval is meestal de energie voor de pijl negatief en groter dan de energie na de pijl. Als d E positief is dan kost de reactie energie, de reactie is dan endotherm. In dit geval is de energie na de pijl groter dan voor de pijl, dit gebeurt meestal als uit niet-ontleedbare stoffen een andere stof wordt gemaakt.Niet-ontleedbare stoffen
De naam zegt het al, een niet-ontleedbare stof kun je niet ontleden, er kan in een reactie dan ook geen ontledingswarmte vrijkomen. Als er na de pijl wel een andere stof gevormd wordt dan kost dat wel energie. In dat geval is d E positief en heb je te maken met een endotherme reactie.© 2016 - 2024 Info-4u, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Reactie- en verbrandingswarmte - theorie en berekeningAls aardgas (CH4) verbrandt vormt het koolstofdioxide en waterdamp. De verbranding van aardgas is een reactie die dageli…
Reactie- en verbrandingswarmte - theorie en berekeningAls aardgas (CH4) verbrandt vormt het koolstofdioxide en waterdamp. De verbranding van aardgas is een reactie die dageli…
 Behoudswetten in vervalreacties - theorie en voorbeeldenIn de scheikunde geldt: de lading voor de reactie is gelijk aan de lading na de reactie. De natuurkunde kent deze regel…
Behoudswetten in vervalreacties - theorie en voorbeeldenIn de scheikunde geldt: de lading voor de reactie is gelijk aan de lading na de reactie. De natuurkunde kent deze regel…
 Hoe oceanen CO2 uit de lucht opnemenEen van de vele maatschappelijke problemen is de hoeveelheid broeikasgassen die in de lucht hangen. De aandacht is voorn…
Hoe oceanen CO2 uit de lucht opnemenEen van de vele maatschappelijke problemen is de hoeveelheid broeikasgassen die in de lucht hangen. De aandacht is voorn…
 Scheikunde - naamgeving koolstofketensHet geven van een naam aan koolstofketens wordt in de scheikunde veel gedaan. Wanneer je de basisregels van het naamgeve…
Scheikunde - naamgeving koolstofketensHet geven van een naam aan koolstofketens wordt in de scheikunde veel gedaan. Wanneer je de basisregels van het naamgeve…
Gerelateerde artikelen
Chemische reactiesTijdens een chemische reactie gaan atomen of moleculen chemische bindingen aan en/of worden er chemische verbindingen ve…
Energie, arbeid en vermogenEnergie is het vermogen om arbeid te verrichten. Alleen door arbeid kunnen er, waar dan ook in het heelal, veranderingen…
Bronnen en referenties
- Inleidingsfoto: Svdmolen At Dutch Wikipedia, Wikimedia Commons (Publiek domein)
- Schoolboek: Chemie 6e editie, vwo 4 leerboek.
Info-4u (13 artikelen)
Laatste update: 18-05-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Laatste update: 18-05-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.