De verschillende verchroom technieken
 Bij verchromen denken we aan galvaniseren (electroplating), een methode die gebruikmaakt van een elektrolyt en elektriciteit om een voorwerp te bedekken met een laagje chroom. Door middel van galvaniseren kan bijvoorbeeld een ijzeren plaat worden voorzien van nikkel (vernikkelen) of chroom (verchromen) om het meer corrosiebestendig te maken of mooier te laten glanzen. In de praktijk onderscheiden we verchromen, chromeren, chromateren, hardvergromen en het spray-chroom-systeem. Deze verschillende "verchroom"-technieken leiden bij niet specialisten tot verwarring en de begrippen worden niet zelden door elkaar gebruikt.
Bij verchromen denken we aan galvaniseren (electroplating), een methode die gebruikmaakt van een elektrolyt en elektriciteit om een voorwerp te bedekken met een laagje chroom. Door middel van galvaniseren kan bijvoorbeeld een ijzeren plaat worden voorzien van nikkel (vernikkelen) of chroom (verchromen) om het meer corrosiebestendig te maken of mooier te laten glanzen. In de praktijk onderscheiden we verchromen, chromeren, chromateren, hardvergromen en het spray-chroom-systeem. Deze verschillende "verchroom"-technieken leiden bij niet specialisten tot verwarring en de begrippen worden niet zelden door elkaar gebruikt.
Inhoud
- Galvanisch verchromen van metalen
- Hardverchromen
- Zelf verchromen met galvanotechniek
- Het spray-chroom-systeem op bases van zilvernitraat
- Chromeren, diffunderen van chroom in het oppervlak
- Chromateren, vorming van chroomverbindingen in het oppervlak
 Galvanisch verchromen / Bron: Stefan-Xp, Wikimedia Commons (CC BY-SA-3.0)
Galvanisch verchromen / Bron: Stefan-Xp, Wikimedia Commons (CC BY-SA-3.0)Galvanisch verchromen van metalen
Verchromen is een oppervlaktebehandeling waarbij het gaat om het esthetisch effect, om het vertragen van corrosie en/of het aanbrengen van een slijtvaste laag. Verchromen wordt op grote schaal toegepast in o.a. de sanitair-, verlichting-, automobiel-, motor- en fietsindustrie. Chroom vormt een oxidehuid die het onderliggende metaal beschermt. Bij (decoratief) verchromen wordt meestal nikkel als onderlaag aangebracht. De nikkellaag geeft het chroom extra glans, terwijl het laagje chroom het product meer slijtvast en corrosiebestendig maakt.Het neerslaan van de nikkel- en chroomcoating op het product is een galvanisch proces waarbij positief geladen nikkel- en chroom-ionen oplossen in de elektrolyt en neerslaan op het negatief geladen te coaten product. De elektrolyt voor verchromen is een giftig waterige oplossing op bases van chroomzuur (H2CrO4). De elektrolyt bestaat uit ongeveer 250g chromoxide (CrO3) per liter met toevoeging van 1% (= 2,5g) zwavelzuur (H2SO4) als katalysator.
Het galvanisch (elektrolytisch) verchromen is duur door een hoog energieverbruik en de extra kosten door het werken met milieu onvriendelijke stoffen, waarbij naleving van de regelgeving t.a.v. het milieu tijdrovend is. Het verchromen is zo goed als het oppervlak voor het verchromen, dus de voorbewerking is erg belangrijk. De meerderheid van de loonkosten zit in schuren, polijsten e.d. en niet in het verchromen.
Normering volgens EN 12540:2000
Corrosiebescherming van metalen door elektrolytisch aangebrachte metallieke deklagen van o.a. nikkel, nikkel-chroom, koper-nikkel en koper-nikkel-chroom.| Laagdikte | Werkruimte | Omstandigheden |
|---|---|---|
| 110 µm/ 0,11 mm | Binnen | Droog en warm |
| 220 µm/ 0,22 mm | Binnen | Vochtig, o.a. door condensatie |
| 330 µm/ 0,33 mm | Buiten | Gematigde corrosieve omstandigheden, industriegebied |
| 440 µm/0,44 mm | Buiten | Zware corrosieve omstandigheden, industriegebied |
Decoratief verchromen
Bij het decoratief verchromen wordt een dunne chroomlaag van 0,2 tot 0,5 µm neergeslagen. Wegens de geringe dikte van zulke chroomlagen worden de eigenschappen, zoals de hardheid en de glans, niet alleen door de chroomlaag bepaald maar ook door de onderliggende (nikkel)laag.
 Hardverchromen / Bron: Wizard191, Wikimedia Commons (CC BY-SA-3.0)
Hardverchromen / Bron: Wizard191, Wikimedia Commons (CC BY-SA-3.0)Hardverchromen
Een hardchroomlaag wordt op dezelfde manier aangebracht als de normale decoratieve chroomlaag, alleen is bij hardchroom de laagdikte veel groter. Hardverchromen is gewoon galvanisch verchromen, maar de spanning is verhoogd en de badtijd verlengd. Decoratief chroom is even hard als hardchroom, maar de laag is veel dunner, bij een hardheidsmeting wordt de onderliggende laag ingedrukt zodat men het idee heeft dat de normale chroomlaag zachter is dan de hardchroomlaag. Laagdikten vanaf 0,5 mm kan men als hardchroom beschouwen. Hardchroomdikte van enkele millimeters komt voor omdat men bijvoorbeeld met de keuze van de chroomlaagdikte bij revisie van een versleten zuiger of cilinder deze weer op de juiste afmeting kan brengen. Hardchroom wordt meestal uitgevoerd met een bases coating van nikkel. De elektrolyt wordt tijdens het galvanisch proces in beweging gehouden om een goed verdeelde chroomneerslag te krijgen.Een normale hardchroomlaag heeft een dicht netwerk van microscopisch fijne scheurtjes, die met het blote oog niet te zien zijn. De scheurtjes worden veroorzaakt door opgesloten waterstof, een deel van het waterstof wordt tijdelijk als chroomhydride in de chroomlaag opgenomen. Bij het verval van deze chroomhydriden, dat wil zeggen bij het ontsnappen van waterstof, krimpt de chroomlaag met als gevolg trekspanningen in de laag die de scheurtjes veroorzaken. Hieruit blijkt dat alleen een chroomlaag niet voldoende is om de corrosiewerende eigenschappen van het chroom honderd procent te benutten. De corrosieweerstand ontstaat in verbinding met tussenlagen als nikkel en/of koper. Het scheurtjesnetwerk heeft als voordeel dat een oliefilm zich er in kan hechten.
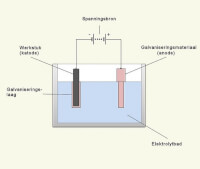 Galvanisch (elektrolytisch) verchromen. De anode en de galvanische laag op het werkstuk (kathode) zijn in dit geval chroom / Bron: Rasbak, Wikimedia Commons (CC BY-SA-3.0)
Galvanisch (elektrolytisch) verchromen. De anode en de galvanische laag op het werkstuk (kathode) zijn in dit geval chroom / Bron: Rasbak, Wikimedia Commons (CC BY-SA-3.0)Zelf verchromen met galvanotechniek
Kleine voorwerpen kan de hobbyist zelf verchromen. De uitrusting bestaat uit een glazen bak, azijn, een strip chroom en een batterij (of accu), die tot 15 volt gelijkstroom kan opbrengen. De elektrolyt is azijn of een sterker zuur. De in de elektrolyt opgeloste opgeloste positieve chroom-ionen worden door het negatief geladen werkstuk aangetrokken, waardoor het verchroomd wordt. De procedure is:- Maak het werkstuk schoon en vetvrij, waar vuil zit, hecht chroom niet.
- Vul een glazen bak met azijn.
- Verbind de min-pool van de stroombron met het werkstuk en de plus-pool met het stripje chroom.
- Dompel beide, vrij hangend, onder in het azijn.
- Na stroom inschakelen ontstaan er belletjes en het werkstuk verkleurt.
- Het verchromen duurt, afhankelijk van de spanning, enkele uren.
- Na het verchromen zit er een doffe laag op het werkstuk.
- Polijsten voor hoogglans.
Opmerking! Na elke oppervlaktebehandeling wordt het werkstuk schoongespoten met gedistilleerd water.
Het spray-chroom-systeem op bases van zilvernitraat
Het spray-chroom-systeem gebruikt zilvernitraat (AgNO3), het is na galvanisch verchromen de beste methode om een beschermende coating aan te brengen op een product.Procedure van spray-chroom-systeem
- Reinigen en vetvrij maken.
- Met gedestilleerd water schoonspuiten.
- Activeringsvloeistof spuiten
- Gedestilleerd water spuiten.
- De zilveroplossing spuiten.
- Met gedestilleerd water schoonspuiten.
- Perslucht om het product te drogen.
- Zodra het artikel droog is, brengt men een speciale lak aan om vergeling te voorkomen.
De spray van het spray-chroom-systeem
De twee componenten spray, op bases van zilvernitraat, wordt automatisch gemengd in de spuitmond. Voor gebruik bij zwaardere eisen zoals de velgen van auto en motor is het beter de onderdelen galvanisch te verchromen.Chromeren, diffunderen van chroom in het oppervlak
Chromeren, ook inchromeren genoemd, niet te verwarren met verchromen (Galvanotechniek), noch met chromateren (chroomverbindingen) noch met poederchroom. Bij chromeren gaat het om een thermochemisch proces in een oven. Chroom uit chroomchloride of chroombromide diffundeert in het staaloppervlak (vandaar de naam inchromeren) en vormt een beschermingslaag tegen corrosie. Bij staal met een laag koolstofgehalte vormt zich een intermetallische ijzer-chroomverbinding. Bij temperaturen rond 1100°C diffundeert chroom in ongelegeerd staal ongeveer 0,01-0,02mm diep, waarbij het chroomgehalte plaatselijk oploopt tot circa 30%. Bij hogere koolstofgehalte in staal vormt zich een harde chroomcarbidelaag die zich tot 800 °C handhaaft. Chromeren wordt toegepast bij onderdelen die bij hoge temperatuur en agressieve omgeving moeten functioneren. Wat technologie betreft is chromeren te vergelijken met carboneren.Chromateren, vorming van chroomverbindingen in het oppervlak
Bij chromateren wordt op/in het metaaloppervlak door chemische inwerking van een chroomzuurhoudende oplossing (H2CrO4)) een chromaatlaag gevormd. Een functie van de chromaatlaag is het vergroten van de corrosieweerstand maar ze dient ook vaak als ondergrond voor andere lagen. Chromateren wordt op aluminium, zink en verzinkt staal toegepast. Chromateren van zink gebeurt door onderdompeling in een bad met een oplossing van chroomzuur en (geheime) toevoegingen. Het vormt zonder hulp van elektrische spanning een dunne chemische laag met een dikte van circa 1,25 micron. Daarna wordt de chromaatlaag uitgehard in een oven bij circa 80°C en daarna kan desgewenst een topcoating (bijv. poedercoating) aangebracht worden in de gewenste kleur. De chromaatlaag zorgt voor een uitstekende hechting tussen aluminium of verzinkt staal en een eventuele topcoating.Chromateren op basis van driewaardig chroom, in plaats van het giftige zeswaardig chroom, geeft alleen een goede corrosiebescherming als de chromaatlaag van een afdeklaag (coating) wordt voorzien, omdat de chromaatlaag namelijk kwetsbaar is en niet slijtvast.
Chromateerlaag door middel van dompelen
De processtappen in achtereenvolgende baden:- Alkalisch ontvetten;
- Spoelen;
- Beitsen;
- Spoelen;
- Chromateren;
- Spoelen;
- Drogen.
De elektrisch geleidende eigenschappen van de chromaat laag verhinderen lokale spanningsverschillen, waardoor de elektrochemische corrosie wordt vertraagd.
Toepassing van chromateren
Chromateren wordt gebruikt voor het passiveren van staal, aluminium, zink, koper, zilver, magnesium en tin. Het wordt voornamelijk gebruikt als corrosieremmer, primer, voor decoratief afwerken of om elektrische geleidbaarheid van een product oppervlak te behouden. Chromaatcoating wordt vaak aangebracht op alledaagse voorwerpen zoals bouwbeslag om de levensduur te verlengen. Staal moet eerst verzinkt worden om te kunnen chromateren. Chromaatcoating op zink wordt herkend door de kleur, lopend van helder naar donker. Donkere coating toont in het algemeen een betere corrosievastheid.© 2015 - 2024 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Het hardverchromen van metalenDoor de zwaarbelaste onderdelen met geavanceerde thermische en galvanische technieken te voorzien van een hardchroom dek…
Het hardverchromen van metalenDoor de zwaarbelaste onderdelen met geavanceerde thermische en galvanische technieken te voorzien van een hardchroom dek…
 Chroom: Het elementChroom is een heldere blauw-witte, hard en corrosiebestendig metaal. Het chroomoxide geeft voorwerpen een groenachtige t…
Chroom: Het elementChroom is een heldere blauw-witte, hard en corrosiebestendig metaal. Het chroomoxide geeft voorwerpen een groenachtige t…
 Zelf de velgen van uw auto spuiten, zo doet u dat!De velgen van uw auto krijgen een hoop te verduren. Het komt dan ook regelmatig voor dat de lak van velgen dof wordt of…
Zelf de velgen van uw auto spuiten, zo doet u dat!De velgen van uw auto krijgen een hoop te verduren. Het komt dan ook regelmatig voor dat de lak van velgen dof wordt of…
 Hoe werkt droogshampoo?Droogshampoo is een product dat inmiddels bekend is bij veel vrouwen. Zij weten dat je het bijvoorbeeld koopt in de drog…
Hoe werkt droogshampoo?Droogshampoo is een product dat inmiddels bekend is bij veel vrouwen. Zij weten dat je het bijvoorbeeld koopt in de drog…
 Beton paalkop of kolomkop moet in bovenliggend beton stekenAls betonpalen of kolommen zijn gesteld, wordt de bovenliggende constructie erover aangebracht. Om een mooie overgang va…
Beton paalkop of kolomkop moet in bovenliggend beton stekenAls betonpalen of kolommen zijn gesteld, wordt de bovenliggende constructie erover aangebracht. Om een mooie overgang va…
Gerelateerde artikelen
Waarom zijn laserpennen zo gevaarlijk?Laserpennen kunnen handig en leuk zijn, maar ook gevaarlijk. Zo kunnen sommige laserpennen blijvende oogschade aanrichte…
Bronnen en referenties
- Inleidingsfoto: Coyau, Wikimedia Commons (CC BY-SA-3.0)
- http://universal_lexikon.deacademic.com/143809/Inchromieren
- http://www.chromin.nl/DE/prozesse/inchromieren
- http://bchromed.eu/chrome/index.html
- http://customcreationpaints.co.uk/
- http://www.chroomtechnologie.nl/
- Info@metalplating.nl
- http://dutch.alibaba.com/product-gs-img/spray-op-chroom-formule-50008247515.html
- https://de.wikipedia.org/wiki/Chromieren
- https://en.wikipedia.org/wiki/Chromate_conversion_coating
- http://www.jonkman-coating.nl/algemeen/diensten/detail/chromateren.aspx?Action=1&M=NewsV2&PID=184
- https://de.wikipedia.org/wiki/Chromelektrolyte
- http://www.multinal.com/verchromen-metalen-producten-onderdelen.html
- http://amklassiek.nl/zelf-verchromen-doe-maar-niet/2014/06/05/
- http://de.wikipedia.org/wiki/Chromieenr
- http://www.paulschrome.com/index.php/all-about-chrome-plating
- http://www.ghamrawy.com/spray-chrome-technology/(foto koplampen)
- http://ibbt.emis.vito.be/ (afbeelding elektrolyse)
- http://www.technoplatingnijkerk.nl/technieken/hardverchromen-vernikkelen
- Afbeelding bron 1: Stefan-Xp, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 2: Atoma, Wikimedia Commons (CC BY-2.5)
- Afbeelding bron 3: Wizard191, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 4: Rasbak, Wikimedia Commons (CC BY-SA-3.0)
Custor (173 artikelen)
Laatste update: 23-12-2016
Rubriek: Wetenschap
Subrubriek: Techniek
Bronnen en referenties: 23
Laatste update: 23-12-2016
Rubriek: Wetenschap
Subrubriek: Techniek
Bronnen en referenties: 23
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.
 Decoratief verchromen van motor onderdelen /
Decoratief verchromen van motor onderdelen /