Elektronconfiguratie opstellen - theorie en voorbeelden
 Alle elementen in het periodieke systeem der elementen beschikken over een aantal protonen. Zo zit er in een waterstofkern 1 proton, terwijl lithiumkernen beschikken over 3 protonen. Ongeladen stoffen, zoals een vast metaal, beschikken op dat moment over een gelijke hoeveelheid elektronen in hun buitenste schil. Aan de hand van deze elektronen is de lading te bepalen van het metaal in het geval dat deze geïoniseerd is. Maar hoe stel je een dergelijke configuratie op?
Alle elementen in het periodieke systeem der elementen beschikken over een aantal protonen. Zo zit er in een waterstofkern 1 proton, terwijl lithiumkernen beschikken over 3 protonen. Ongeladen stoffen, zoals een vast metaal, beschikken op dat moment over een gelijke hoeveelheid elektronen in hun buitenste schil. Aan de hand van deze elektronen is de lading te bepalen van het metaal in het geval dat deze geïoniseerd is. Maar hoe stel je een dergelijke configuratie op?
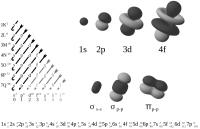 Figuur 1: verschillende orbitalen / Bron: Patricia.fidi, Wikimedia Commons (Publiek domein)
Figuur 1: verschillende orbitalen / Bron: Patricia.fidi, Wikimedia Commons (Publiek domein)Elektron-orbitalen
Alle atomen hebben te maken met orbitalen waarin de elektronen zich bevinden. Deze orbitalen geven aan waar een elektron zich 95% van de tijd bevindt. De orbitalen geven dus geen grens aan, maar een kans om een elektron op een bepaalde positie te vinden om de atoomkern. Deze orbitalen kunnen aangevuld of geleegd worden door een binding aan te gaan met andere stoffen, bijvoorbeeld door een redoxreactie. De elektronenconfiguratie verandert hierbij, waardoor ook de notatie verandert. Opmerkelijk is ook hoe de hoeveelheid elektronen van alle nobelgassen voldoet aan de formule 2n2, waarbij n het nummer van de periode is waar het nobelgas zich in bevindt.Elektronenconfiguratie
De elektronenconfiguratie van een atoom opstellen vereist kennis van de verschillende orbitalen. In figuur 1 wordt iets duidelijker hoe een orbitaal werkt. Onderaan de 's'-reeks staat een s2. Dit betekent dat het s-orbitaal maximaal 2 elektronen vast kan houden voordat deze volledig is gevuld. Onderaan de 'p'-reeks staat een p6. Dat betekent dat het p-orbitaal maximaal 6 elektronen kan vasthouden voor deze vol zit. Voor elk orbitaal staat de maximale hoeveelheid elektronen genoteerd aan de onderkant dan de desbetreffende rij. Ook moet het schilnummer worden vermeld zodra deze schil 'vol' zit. In figuur 1 staat een voorbeeld van een dergelijke notatie: 1s2, 2s2, 2p6, 3s2 enzovoort. De getallen aan de rechteronderkant van de orbitalen geven de som weer van de elektronen rond het atoom. Deze notatie is niet verplicht maar maakt de notatie wel completer.Aufbau-principe
In figuur 1 staan enkele pijlen die verticaal naar linksonder wijzen. Dit is het Aufbau-principe waar rekening mee moet worden gehouden. Het Aufbau-principe berust op de theorie dat elk orbitaal afbouwend moet worden gevuld met elektronen. Aan de hand van enkele voorbeelden zal dit duidelijk worden gemaakt, waarbij de som van de elektronen niet zal worden vermeld.Voorbeeld 1a: Natrium
Natrium is een element met atoomnummer 11. Dat houdt in dat metallisch natrium 11 protonen in de kern heeft, en daarom ook 11 elektronen rond de kern heeft zweven. Dat geeft 1s2 2s2 2p6 3s1. Dit zijn 2 + 2 + 6 + 1 = 11 elektronen, volgens het Aufbau-principe. Dit klopt dus.Voorbeeld 2a: Zwavel
Zwavel is een element met atoomnummer 16. Oftewel, de totale hoeveelheid elektronen moet 16 zijn. Dit geeft 1s2 2s2 2p6 3s2 3p4. Dit is volgens het Aufbau-principe, met in totaal 2 + 2 + 6 + 2 + 4 = 16 elektronen. Dit klopt dus.Voorbeeld 3a: Broom
Broom is een element met atoomnummer 35. Hierin moeten dus 35 elektronen aanwezig zijn. Dit geeft 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Dit is volgens het Aufbau-principe, en de som is 2 + 2 + 6 + 2 + 6 + 2 + 10 + 5 = 35. Dit klopt dus.Nobelgas-notatie
De nobelgas-notatie is een versimpelde manier van het noteren van de elektronenconfiguratie, die vooral bij zwaardere elementen van pas komt vanwege hun lange configuraties. De nobelgas-configuratie berust eigenlijk op het vinden van de gevulde schillen in nobelgas-configuratie, door deze vervolgens te vervangen met [nobelgas-symbool] in de notatie. Hierdoor wordt tijd en schrijfruimte bespaard. Aan de hand van enkele voorbeelden wordt dit duidelijk gemaakt.Voorbeeld 1b: Natrium
Natrium is een element dat direct na het nobelgas neon komt. Om de nobelgas-notatie van natrium te vinden moet eerst worden gekeken naar de elektronconfiguratie van neon en natrium.- Neon heeft 10 protonen, dus ook 10 elektronen. Dit geeft 1s2 2s2 2p6.
- Natrium heeft als configuratie 1s2 2s2 2p6 3s1. Overeenkomend is 1s2 2s2 2p6.
- De nobelgas-notatie van natrium is [Ne] 3s1.
Voorbeeld 2b: Zwavel
Zwavel komt voor argon, dus deze notatie is niet mogelijk. Wel is een notatie met neon mogelijk.- Neon heeft 10 protonen, dus ook 10 elektronen. Dit geeft 1s2 2s2 2p6.
- Zwavel heeft als configuratie 1s2 2s2 2p6 3s2 3p4. Overeenkomend is 1s2 2s2 2p6.
- De nobelgas-notatie van zwavel is [Ne] 3s2 3p4
Voorbeeld 3b: Broom
Broom komt voor krypton, dus deze notatie is niet mogelijk. Wel is een notatie met argon mogelijk.- Argon heeft 18 protonen, dus ook 18 elektronen. Dit geeft 1s2 2s2 2p6 3s2 3p6.
- Broom heeft als configuratie 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Overeenkomend is 1s2 2s2 2p6 3s2 3p6.
- De nobelgas-notatie van broom is [Ar] 4s2 3d10 4p5.
© 2017 - 2024 Dysprosium, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Orbitaal- en hybridisatietheorie bij de koolwaterstoffenKoolstof speelt de hoofdrol in de organische scheikunde. Om de ruimtelijke structuur van koolwaterstoffen te verklaren i…
Orbitaal- en hybridisatietheorie bij de koolwaterstoffenKoolstof speelt de hoofdrol in de organische scheikunde. Om de ruimtelijke structuur van koolwaterstoffen te verklaren i…
 Binden zonder edelgasconfiguratieWanneer atomen bindingen vormen met andere atomen, doen ze dit om de stabiele edelgasconfiguratie te verkrijgen. De edel…
Binden zonder edelgasconfiguratieWanneer atomen bindingen vormen met andere atomen, doen ze dit om de stabiele edelgasconfiguratie te verkrijgen. De edel…
 Sterisch getal, hybridisatie en moleculaire geometrieEen Lewisstructuurformule vertelt ons hoe de samenstellende atomen van een molecule onderling met elkaar zijn gebonden e…
Sterisch getal, hybridisatie en moleculaire geometrieEen Lewisstructuurformule vertelt ons hoe de samenstellende atomen van een molecule onderling met elkaar zijn gebonden e…
 De zeven perioden van het periodiek systeemHorizontaal wordt het periodiek systeem ingedeeld in 7 perioden. Deze indeling werd gedaan op basis van de 7 schillen ui…
De zeven perioden van het periodiek systeemHorizontaal wordt het periodiek systeem ingedeeld in 7 perioden. Deze indeling werd gedaan op basis van de 7 schillen ui…
 Gaschromatografie: een nauwkeurige analyse van mengselsAls je een druppel gekleurde inkt op je overhemd krijgt, ontstaat een vlek met kringen. Die kringen ontstaan doordat de…
Gaschromatografie: een nauwkeurige analyse van mengselsAls je een druppel gekleurde inkt op je overhemd krijgt, ontstaat een vlek met kringen. Die kringen ontstaan doordat de…
 Massapercentage berekenen - theorie en voorbeeldenIn de scheikunde moeten veel dingen worden berekend: de E-factor, de hoeveelheid mol of een percentage. Vaak zijn zulke…
Massapercentage berekenen - theorie en voorbeeldenIn de scheikunde moeten veel dingen worden berekend: de E-factor, de hoeveelheid mol of een percentage. Vaak zijn zulke…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: OpenClipart-Vectors, Pixabay
- https://www.ptable.com/
- http://www.iun.edu/~cpanhd/C101webnotes/modern-atomic-theory/aufbau-principle.html
- Afbeelding bron 1: Patricia.fidi, Wikimedia Commons (Publiek domein)
Dysprosium (40 artikelen)
Laatste update: 01-02-2018
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 4
Laatste update: 01-02-2018
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 4
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.