Metalen zuiveren met behulp van elektriciteit
 Met behulp van elektrolyse kan je een ruw (verontreinigd) metaal zuiveren. Je laat het metaal hierbij anodisch oxideren uit het onzuivere metaal en je laat het weer kathodisch reduceren op een blok van het zuivere metaal. Door de spanning juist in te stellen, vermijd je de verontreiniging van het de gezuiverde blok met andere metalen.
Met behulp van elektrolyse kan je een ruw (verontreinigd) metaal zuiveren. Je laat het metaal hierbij anodisch oxideren uit het onzuivere metaal en je laat het weer kathodisch reduceren op een blok van het zuivere metaal. Door de spanning juist in te stellen, vermijd je de verontreiniging van het de gezuiverde blok met andere metalen.
Inhoud
- Elektrolyse
- Reducerend vermogen van metalen
- Oxiderend vermogen van metaal-ionen
- Zuivering van een metaal
- Regeling van de spanning
- Zwakke reductor
- Sterke reductor
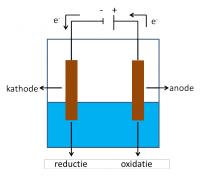
Elektrolyse
Bij elektrolyse worden twee elektroden verbonden met een stroombron en in de te elektrolyseren oplossing of smelt gebracht. De elektrode verbonden met de negatieve pool van de stroombron wordt de kathode genoemd. De andere elektrode vormt de anode. De elektronen stromen van de anode naar de kathode. Aan de kathode zal een reductie optreden. De stof die wordt gereduceerd, zal hierbij elektronen opnemen. Aan de anode zal een stof elektronen afgeven en alzo worden geoxideerd.Reducerend vermogen van metalen
Alle metalen hebben een bepaald reducerend vermogen. Sterk reducerende metalen zullen graag elektronen afgeven en dus gemakkelijk geoxideerd worden.M → Mn+ + n e-
Oxiderend vermogen van metaal-ionen
Sterk reducerende metalen kunnen worden omgezet in zwak oxiderende metaal-ionen. Een sterk oxiderend metaal-ion neemt graag elektronen op ter vorming van een zwak reducerend metaal.Mn+ + n e- → M
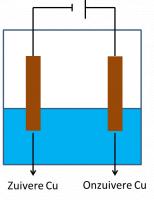
Zuivering van een metaal
Elektrolyse kan gebruikt worden voor de zuivering van onzuivere metalen die door andere industriële processen bekomen worden. Hierbij gebruikt men het onzuiver metaal als anode gedompeld in een oplossing van een zout welke het metaal-ion bevat van het betrokken metaal.Voor de zuivering van koper bijvoorbeeld gaat men uit van ruwe koperblokken chemisch bereid uit kopererts. Als kathode doet een dunne plaat zuivere koper dienst. Tijdens de elektrolyse groeit deze plaat voortdurend aan omdat de uit het ruwe koper vrijgekomen koper-ionen er na reductie op vastgehecht worden. De meest gebruikte elektrolyt is een oplossing van zwavelzuur en kopersulfaat in water.
- Kathodische reductie (zuivere koper): Cu2+ + 2e- → Cu
- Anodische oxidatie (ruwe koper): Cu → Cu2+ + 2e-
Regeling van de spanning
Men kan de elektrische spanning zo regelen dat de onzuiverheden niet geëlektrolyseerd worden of in oplossing blijven.Zwakke reductor
Indien de ruwe koper bijvoorbeeld ook zilver bevat, welke een zwakke reductor is. Dan zal bij een spanning waarbij koper uit het ruwe koper wordt geoxideerd niet hoog genoeg zijn om ook zilver. Te oxideren zilver zal dus bij elektrolyse in het blok blijven of bij eventuele afbrokkeling van het blok op de bodem van het reactievat vallen.Sterke reductor
Indien de ruwe koper bijvoorbeeld ook ijzer bevat, welke een sterkere reductor is dan koper. Dan zal de aangelegde spanning wel hoog genoeg zijn om naast Cu2+-ionen ook Fe2+-ionen te vormen. Deze Fe2+-ionen zullen echter in oplossing blijven en niet gereduceerd worden aan de zuivere koperplaat. Fe2+ is immers een zwakkere oxidator dan Cu2+ en vraagt dus een hogere spanning om terug gereduceerd te worden tot ijzer.© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Kwantitatieve elektrolyse als analytische methodeWanneer men door een elektrolytoplossing of -smelt een gelijkstroom stuurt, zal er aan de negatieve pool een gedwongen r…
Kwantitatieve elektrolyse als analytische methodeWanneer men door een elektrolytoplossing of -smelt een gelijkstroom stuurt, zal er aan de negatieve pool een gedwongen r…
 Galvanische cel versus elektrolytische celEen galvanische en een elektrolytische cel zijn beiden gebaseerd op redoxreacties waarvan beide halfreacties doorgaan in…
Galvanische cel versus elektrolytische celEen galvanische en een elektrolytische cel zijn beiden gebaseerd op redoxreacties waarvan beide halfreacties doorgaan in…
 De Li-ionbatterij, klein maar krachtigIn 2019 ging de Nobelprijs voor de scheikunde naar de uitvinders van de Li-ionbatterij. Li is dankzij zijn kleine massa…
De Li-ionbatterij, klein maar krachtigIn 2019 ging de Nobelprijs voor de scheikunde naar de uitvinders van de Li-ionbatterij. Li is dankzij zijn kleine massa…
 Aggregatietoestanden en intermoleculaire krachtenDe aggregatietoestand van een stof (vast, vloeibaar of gasvormig) staat in direct verband met de intermoleculaire kracht…
Aggregatietoestanden en intermoleculaire krachtenDe aggregatietoestand van een stof (vast, vloeibaar of gasvormig) staat in direct verband met de intermoleculaire kracht…
 Chemische reacties in de koolstofchemie: een overzichtIn de minerale chemie bestuderen we neutralisatiereacties, neerslagreacties, complexvormingsreacties en redoxreacties. H…
Chemische reacties in de koolstofchemie: een overzichtIn de minerale chemie bestuderen we neutralisatiereacties, neerslagreacties, complexvormingsreacties en redoxreacties. H…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: Hans, Pixabay
Guust2016 (74 artikelen)
Laatste update: 08-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 1
Laatste update: 08-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 1
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.