De kationenuitwisselingscapaciteit van een bodem
 Planten moeten voor hun groei kationen absorberen uit de bodem. Het is niet voldoende dat die kationen worden toegevoegd, natuurlijk of kunstmatig, aan de bodem. Het is ook noodzakelijk dat de bodemdeeltjes deze kationen kunnen adsorberen want anders zullen deze voedingsstoffen gewoon wegspoelen en dus niet beschikbaar zijn voor de planten. Niet elke grond kan evenveel kationen binden. Het is dus zeer nuttig uit plantenvoedingsoogpunt te weten hoeveel kationen een bepaalde grond kan binden.
Planten moeten voor hun groei kationen absorberen uit de bodem. Het is niet voldoende dat die kationen worden toegevoegd, natuurlijk of kunstmatig, aan de bodem. Het is ook noodzakelijk dat de bodemdeeltjes deze kationen kunnen adsorberen want anders zullen deze voedingsstoffen gewoon wegspoelen en dus niet beschikbaar zijn voor de planten. Niet elke grond kan evenveel kationen binden. Het is dus zeer nuttig uit plantenvoedingsoogpunt te weten hoeveel kationen een bepaalde grond kan binden.
Inhoud
- Grondsoorten
- Deeltjesgrootte t.o.v. contactoppervlakte
- Kationenuitwisselingscapaciteit van de bodem
- Bepaling van de kationenuitwisselingscapaciteit
- Werkwijze
Grondsoorten
Elke bodem heeft een unieke kleur, textuur en opslagcapaciteit voor voedzame chemicaliën. Een bodem is samengesteld uit zand, leem en/of klei en organisch materiaal. Kleigrond heeft een vochtige en vaste structuur. Zuurstof kan moeilijk doordringen en daarvoor moet deze grond regelmatig worden verlucht. De grond houdt heel gemakkelijk water vast en wordt na een aantal regendagen al snel te vochtig. Deze gronden worden dus het beste af en toe gedraineerd. Zandgrond heeft een droge en losse structuur. Het is een zuurstofrijke grond maar water stroomt gemakkelijk weg. Zandgronden zijn minder geschikt voor akker- en tuinbouw. Leem heeft een lossere structuur dan klei maar is vaster dan zand. Het houdt voldoende water vast en bevat voldoende zuurstofgas. Dit maakt van leem dan ook een vruchtbare grondsoort.Deeltjesgrootte t.o.v. contactoppervlakte
Om voldoende kationen te adsorberen moet de bodem een zeker contactoppervlakte ter beschikking hebben. De korrelgrond van de bodemdeeltjes neemt toe van klei, over leem naar zand. Een kleinere korrelgrootte komt overeen met een groter contactoppervlak voor hetzelfde volume deeltjes. Ionen kunnen door elektrostatische krachten aan de korrels blijven plakken, losse deeltjes zullen worden weggespoeld. Bodemdeeltjes zijn meestal negatief geladen en zijn dus in staat om positieve kationen te binden. Zonder de aanwezigheid van water zou deze interactie permanent zijn en zouden de kationen niet beschikbaar zijn voor de plant. Door aanwezigheid van water bestaat er echter een watermantel rond de ionen zodat permanente vasthechting voorkomen wordt. Kationen kunnen dan worden uitgewisseld door anderen. Planten produceren waterstofkationen en kunnen deze uitwisselen voor andere kationen. Hoe hoger de lading van de ionen, hoe moeilijker ze zullen worden uitgewisseld. Sulfaten en nitraten zijn echter negatief geladen deeltjes. Deze zullen dus niet worden gebonden aan een negatief geladen bodem. Zandbodems hebben door hun grote korrels slechts een klein contactoppervlakte. Bovendien stroomt water met kationen ook gemakkelijk weg in deze bodems. Kleigronden hebben een groot contactoppervlakte maar door hun slechte doordringbaarheid worden kationen moeilijk aangevoerd.Kationenuitwisselingscapaciteit van de bodem
Een bodem met een grote kationenuitwisselingscapaciteit is voldoende negatief geladen, heeft een groot contactoppervlak en kent een goede waterhuishouding. Voor een vruchtbare akker- en tuinbouw is het dus belangrijk om deze capaciteit van de beschikbare bodem te kennen. Met deze kennis weet je dan hoe je je bodem moet bemesten.Bepaling van de kationenuitwisselingscapaciteit
De kwantitatieve bepaling van de adsorptiecapaciteit wordt uitgevoerd door eerst alle uitwisselbare ionen te vervangen door NH4+-ionen en vervolgens deze NH4+-ionen uit te wisselen door een ander kation. Je laat hiervoor een kationenoplossing door de met NH4+-ionen behandelde bodem stromen. Hierdoor zullen de NH4+-ionen loskomen en de andere kationen worden gebonden. Het gehalte aan uitgewisselde NH4+-ionen kan dan bepaald worden in de vloeistof.Kationenuitwisselingscapaciteit = de hoeveelheid NH4+/100g grond
Werkwijze
MateriaalLuchtdroge grond, kwartszand, ammoniumacetaat-oplossing (1mol/L), ethanol, KCl-oplossing (1mol/L), fenolftaleïne, MgO, boorzuuroplossing (2m%), HCl-oplossing (0,01 mol/L), mengindicator (methylrood, broomcresolgroen, ethanol).
Experiment
- Meng 10 g luchtdroge grond met 50 g kwartszand in een beker.
- Breng dit mengsel in een kolom en breng nog 10 g kwartszand boven op het mengsel.
- Elueer met 250 mL ammoniumacetaat-oplossing.
- Verwijder de overmaat ammoniumionen door te wassen met 300 mL ethanol.
- Breng nu de inhoud van de kolom kwantitatief over in een erlenmeyer van 250 mL.
- Voeg 100 mL KCl-oplossing toe en schud gedurende een half uur.
- Filtreer het geheel door een papierfilter in een droge erlenmeyer.
- Pipeteer 10 ml van het filtraat in een destillatiekolf en voeg 1 g MgO en 2 druppels fenolftaleïne toe. In de reactie tussen NH4+-ionen en MgO ontstaat het vluchtige NH3.
- Destilleer over in 10 mL boorzuuroplossing. Hierbij wordt (NH4)3BO3 gevormd.
- Titreer met de HCl-oplossing, voeg eerst enkele druppels indicator toe.
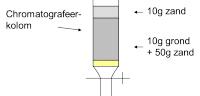 Uitwisseling van aanwezige kationen tegen NH4+
Uitwisseling van aanwezige kationen tegen NH4+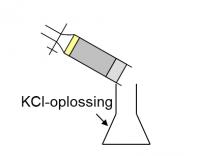 Vervanging van de geadsorbeerde NH4+-ionen door K+-ionen.
Vervanging van de geadsorbeerde NH4+-ionen door K+-ionen.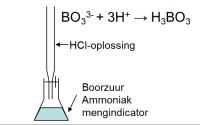 Bepaling van de hoeveelheid NH4+-ionen door titratie met HCl
Bepaling van de hoeveelheid NH4+-ionen door titratie met HCl© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Zuur minnende plantenElke tuin heeft zijn eigen type grond. Er zijn tuinen met kleigrond, zand- of veengrond. Sommige planten maakt het niet…
Zuur minnende plantenElke tuin heeft zijn eigen type grond. Er zijn tuinen met kleigrond, zand- of veengrond. Sommige planten maakt het niet…
 Jaar van de Bodem – International Year of SoilsHet jaar 2015 is door de Wereldvoedsel Organisatie FAO, de Food and Agriculture Organization van de Verenigde Naties, ui…
Jaar van de Bodem – International Year of SoilsHet jaar 2015 is door de Wereldvoedsel Organisatie FAO, de Food and Agriculture Organization van de Verenigde Naties, ui…
 Uitsterven van vogels door toedoen van de mensDe mens blijkt uit de geschiedenis de grootste bedreiging voor diersoorten. Zo zijn zij ook verantwoordelijk geweest voo…
Uitsterven van vogels door toedoen van de mensDe mens blijkt uit de geschiedenis de grootste bedreiging voor diersoorten. Zo zijn zij ook verantwoordelijk geweest voo…
 Bodemsoort van je tuin bepalenAls je je tuin gaat (her)inrichten, is het belangrijk te weten met welke bodemsoort je te maken hebt. Er zijn namelijk v…
Bodemsoort van je tuin bepalenAls je je tuin gaat (her)inrichten, is het belangrijk te weten met welke bodemsoort je te maken hebt. Er zijn namelijk v…
 De chemische werking van een 'hot ice' hotpackEen hotpack bestaat uit een plastic zakje met daarin een oververzadigde oplossing en een metalen muntje. Wanneer je het…
De chemische werking van een 'hot ice' hotpackEen hotpack bestaat uit een plastic zakje met daarin een oververzadigde oplossing en een metalen muntje. Wanneer je het…
 De scheikundige werking van een instant coldpackIn de sportwereld wordt er regelmatig gebruik gemaakt van een instant coldpack om zwellingen bij blessures te voorkomen…
De scheikundige werking van een instant coldpackIn de sportwereld wordt er regelmatig gebruik gemaakt van een instant coldpack om zwellingen bij blessures te voorkomen…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: Couleur, Pixabay
Guust2016 (74 artikelen)
Laatste update: 21-10-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 1
Laatste update: 21-10-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 1
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.