Concentratiebepalingen met de wet van Lambert-Beer
 UV-VIS-spectrofotometrie is een dankbare methode om concentratiebepalingen te doen. Door te meten hoeveel fotonen een staal uit een lichtbundel absorbeert, kan de concentratie van het staal worden bepaald op basis van de wet van Lambert-Beer. De bepaling van de concentratie kan rechtstreeks of via de ijklijn- of standaardadditiemethode.
UV-VIS-spectrofotometrie is een dankbare methode om concentratiebepalingen te doen. Door te meten hoeveel fotonen een staal uit een lichtbundel absorbeert, kan de concentratie van het staal worden bepaald op basis van de wet van Lambert-Beer. De bepaling van de concentratie kan rechtstreeks of via de ijklijn- of standaardadditiemethode.
- Absorptie en emissie van straling
- Absorptiespectrum van een stof
- Wet van Lambert-Beer
- Concentratiebepalingen
- Op basis van 1 meting
- Op basis van de ijklijnmethode
- Op basis van de standaardadditiemethode
Absorptie en emissie van straling
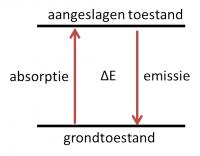 Figuur 1
Figuur 1Om naar de aangeslagen toestand te gaan, dient een atoom een bepaalde hoeveelheid energie op te absorberen. In figuur 1 is dit E. Indien het atoom terugvalt naar de grondtoestand, komt diezelfde hoeveelheid energie weer vrij. Dit proces wordt emissie genoemd. Licht kan worden beschouwd als een bundel lichtdeeltjes of fotonen. Fotonen hebben afhankelijk van de golflengte van het licht een zekere hoeveelheid energie. Licht met een lagere golflengte bestaat uit fotonen met een hogere energie en omgekeerd.
Efoton = (h.c)/λ
Met:
- h = de constante van Planck = 6,63.10-34J.s.
- c = de lichtsnelheid (3.108 m/s)
- λ = de golflengte van het licht (m)
Voor elke overgang van de grondtoestand naar een bepaalde aangeslagen toestand, is er dus licht met een welbepaalde golflengte nodig.
Absorptiespectrum van een stof
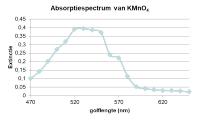 Figuur 2
Figuur 2Wet van Lambert-Beer
Volgens de wet van Lambert-Beer bestaat er enerzijds een recht evenredig verband tussen de extinctie (of absorbantie) en de concentratie van het staal. Hoe meer moleculen er per volume staal aanwezig zijn, hoe meer licht dit staal zal absorberen. Verder bestaat er ook een recht evenredig verband tussen de extinctie en de weglengte die het licht door het staal aflegt. Hoe groter de afstand die het licht door het staal aflegt, hoe meer licht er zal worden geabsorbeerd.E (of A) = ε.l.c
Met
- E (A) = de extinctie (absorbantie)
- ε = de extinctiecoëfficiënt (constante) van de onderzochte stof
- l = weglengte van het licht door het staal
- c = de concentratie van de stof
De extinctie kan niet rechtstreeks worden gemeten. Wanneer je licht van een bepaalde golflengte door een staal stuurt, zal een deel van dit licht worden geabsorbeerd door het staal. Je kan met een spectrofotometer wel meten hoeveel licht het staal nog doorlaat, de transmissie T.
T = It/I0
Met
- It = de intensiteit van het licht na doorgang door het staal
- I0 = de intensiteit van licht na doorgang door een blanco.
Uit deze T-waarde kan de extinctie worden berekend.
E = log (It/I0)
Concentratiebepalingen
De wet van Lambert-Beer laat toe om kwantitatieve bepalingen te doen binnen UV/VIS-spectrofotometrie. Met deze techniek kan bepaald worden hoeveel licht een staal absorbeert uit een lichtbundel afkomstig van een gloeilamp (VIS = zichtbaar licht) of van een deuteriumlamp (UV = ultra-violet licht). Met de extinctie van een oplossing kan dan met behulp van de wet de concentratie van de oplossing worden bepaald.Op basis van 1 meting
Deze bepaling is niet zo nauwkeurig en kan alleen maar worden toegepast indien de extinctiecoëfficiënt van de te bepalen stof gekend is. Er dient dus slechts 1 meting te worden uitgevoerd en met de gemeten extinctie kan onmiddellijk de concentratie worden berekend. Deze metingen zijn wel interessant om snel een richtwaarde te hebben.c = E/(ε.l)
Op basis van de ijklijnmethode
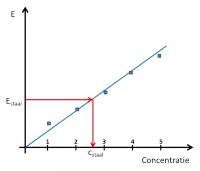 ijklijnmethode
ijklijnmethodeOp basis van de standaardadditiemethode
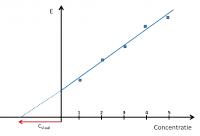 standaardadditiemethode
standaardadditiemethode© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Kwantummechanica: het foto-elektrisch effectOmstreeks 1925 werd de theorie kwantummechanica geformuleerd. Veel verschijnselen die ontdekt waren op atomaire schaal k…
Kwantummechanica: het foto-elektrisch effectOmstreeks 1925 werd de theorie kwantummechanica geformuleerd. Veel verschijnselen die ontdekt waren op atomaire schaal k…
 Absorptie en emissie door elektronenNiels Bohr was een Deens wetenschapper die aan het begin van de 20ste eeuw een verband legde tussen de kleureffecten bij…
Absorptie en emissie door elektronenNiels Bohr was een Deens wetenschapper die aan het begin van de 20ste eeuw een verband legde tussen de kleureffecten bij…
 SpectofotometrieSpectofotometrie is een methode om gehaltes van bepaalde stoffen in een oplossing te bepalen door middel van licht. Ik z…
SpectofotometrieSpectofotometrie is een methode om gehaltes van bepaalde stoffen in een oplossing te bepalen door middel van licht. Ik z…
 Kolomchromatografie versus dunnelaagchromatografieChromatografie is een scheidingstechniek gebaseerd op een opdeling van stoffen over twee niet-mengbare fasen. Deze twee…
Kolomchromatografie versus dunnelaagchromatografieChromatografie is een scheidingstechniek gebaseerd op een opdeling van stoffen over twee niet-mengbare fasen. Deze twee…
 Binden zonder edelgasconfiguratieWanneer atomen bindingen vormen met andere atomen, doen ze dit om de stabiele edelgasconfiguratie te verkrijgen. De edel…
Binden zonder edelgasconfiguratieWanneer atomen bindingen vormen met andere atomen, doen ze dit om de stabiele edelgasconfiguratie te verkrijgen. De edel…
Gerelateerde artikelen
Principes van spectrofotometrieSpectrofotometrie is een techniek die gebruikt wordt om de kleursterkte te bepalen bij proeven met een kleuromslag princ…
Bronnen en referenties
- Analytische scheikunde 2, W. Biermans, A. Pyra en F. Schuyten
Guust2016 (74 artikelen)
Gepubliceerd: 24-03-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 1
Gepubliceerd: 24-03-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 1
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.