Het azeotroop gedrag van een ethanol-watermengsel
 Een ethanol-watermengsel kan door middel van een destillatie nooit volledig worden gescheiden in zuivere ethanol en zuiver water. Herhaaldelijk destilleren levert hoogstens een mengsel met 96% ethanol op, de azeotrope samenstelling. Het azeotroop mengsel heeft een kookpunt dat lager is dan dat van water maar dat ook lager is dan dat van zuivere ethanol. Bij de azeotrope samenstelling heeft de dampfase bovendien dezelfde samenstelling als de vloeistoffase. Dit verklaart deze onmogelijke scheiding.
Een ethanol-watermengsel kan door middel van een destillatie nooit volledig worden gescheiden in zuivere ethanol en zuiver water. Herhaaldelijk destilleren levert hoogstens een mengsel met 96% ethanol op, de azeotrope samenstelling. Het azeotroop mengsel heeft een kookpunt dat lager is dan dat van water maar dat ook lager is dan dat van zuivere ethanol. Bij de azeotrope samenstelling heeft de dampfase bovendien dezelfde samenstelling als de vloeistoffase. Dit verklaart deze onmogelijke scheiding.
- Destilleren
- Damp- en kooklijn van een mengsel zonder azeotroop gedrag
- Kooklijn
- Damplijn
- Scheiding van de componenten
- Kook- en damplijn bij niet-ideale mengsels
- Mengsels met een minimum azeotroop
- Mengsels met een maximum azeotroop
- Scheiding van ethanol-water
- Absolute ethanol
Destilleren
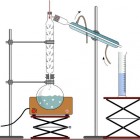
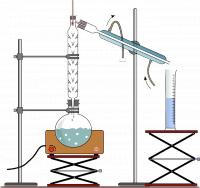 Destillatieopstelling / Bron: OpenClipart Vectors, Pixabay
Destillatieopstelling / Bron: OpenClipart Vectors, PixabayHet te scheiden mengsel wordt in een kolf gebracht en verwarmt. De stof met het laagste kookpunt zal als eerste verdampen. Het gas stijgt en zal zo de liebigkoeler bereiken, waar het weer afkoelt en condenseert. Dit condensaat kan dan worden opgevangen in bijvoorbeeld een maatcilinder. Op de figuur staat een gefractioneerde destillatie-opstelling afgebeeld. In de toegevoegde fractioneerkolom wordt een aantal keer het verdampen afgewisseld met het condenseren. Dit aantal hangt af van het aantal uitstulpingen in de fractioneerkolom. Dit zorgt voor een betere scheiding van mengsels waarvan de samenstellende componenten een klein verschil in kookpunt hebben.
Damp- en kooklijn van een mengsel zonder azeotroop gedrag
Kooklijn
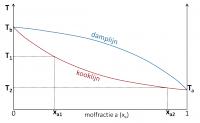
Damplijn
De kookcurve en dampcurve van een mengsel zonder azeotroop gedrag raken elkaar in hun uitersten, namelijk als de vloeistof uit zuiver a of zuiver b bestaat. In dit geval is de samenstelling van de damp gelijk aan die van de vloeistof.
Scheiding van de componenten
De damp van een kokend mengsel is dus rijker aan de vluchtigste component van het mengsel. Indien deze damp opnieuw condenseert, is het verkregen mengsel dus rijker aan de vluchtigste component (stap 1). Indien dit nieuwe mengsel opnieuw aan de kook wordt gebracht, zal zijn damp nog rijker zijn aan de vluchtigste component (stap 2). Deze handeling kan worden herhaald tot de verkregen condens 100% uit de vluchtigste component bestaat (stap 3). Via gefractioneerde destillatie kan dus een volledige scheiding van de samenstellende componenten worden verkregen.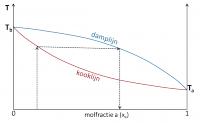 Stap 1
Stap 1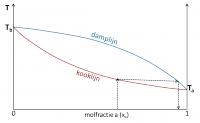 Stap 2
Stap 2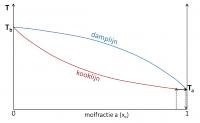 Stap 3
Stap 3Kook- en damplijn bij niet-ideale mengsels
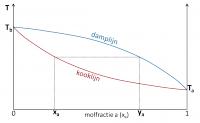
Sommige mengsels vertonen afwijkende kook- en dampcurves. De curves kunnen een minimum of een maximum vertonen. Bij dit minimum of maximum raken kook- en dampcurves elkaar. Bij deze samenstelling van het mengsel heeft de damp dus dezelfde samenstelling als de vloeistof. In dit geval spreekt men van een azeotroop mengsel.Mengsels met een minimum azeotroop
Voor deze mengsels is de damp links van dit punt in de curve rijker aan de vluchtigste component. Rechts echter is de damp van het mengsel rijker aan de minder vluchtige component. Een voorbeeld van een mengsel met een minimum is water-ethanol.Mengsels met een maximum azeotroop
Voor deze mengsels is de damp links van dit punt in de curve rijker aan de vluchtigste component. Rechts echter is de damp rijker aan de minder vluchtige component. Een voorbeeld van een mengsel met een maximum is aceton-chloroform.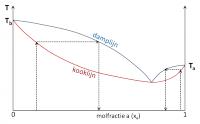 Azeotroop met minimum
Azeotroop met minimum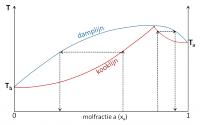 Azeotroop met maximum
Azeotroop met maximumDit afwijkend gedrag is het gevolg van een verschil in intermoleculaire krachten in de zuivere vloeistoffen en in de mengsels. Bij mengsels met een minimum azeotroop zijn de interacties in het mengsel zwakker dan in de zuivere vloeistoffen. De damplijn ligt hier lager. Er is dus meer koeling nodig om de dampen te condenseren. Moleculen in een mengsel met een maximum azeotroop zijn sterker tot elkaar aangetrokken dan in de zuivere stoffen. Ze zijn minder geneigd om de vloeistof te verlaten, waardoor de kooklijn hoger ligt.
Scheiding van ethanol-water
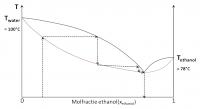
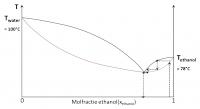
Absolute ethanol
Absolute ethanol is zuivere en dus watervrije ethanol. Dit kan worden verkregen door toevoeging van benzeen aan het ethanol-watermengsel. Water en benzeen vormen samen ook een azeotroop met een kooktemperatuur lager dan het kookpunt van de ethanol-water azeotroop. Water en benzeen kunnen dus samen worden afgedestilleerd. Na deze destillatie blijft dan zuivere ethanol over.© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Aanduiding proof bij alcoholische drankenMisschien heb je op een fles met alcoholische drank weleens de term "proof" zien staan. Wat houdt deze term nu precies i…
Aanduiding proof bij alcoholische drankenMisschien heb je op een fles met alcoholische drank weleens de term "proof" zien staan. Wat houdt deze term nu precies i…
 Bio-ethanol voor haard kopenBio-ethanol lijkt steeds meer de plaats van hout in te nemen als brandstof voor in de open haard. Veel Nederlanders kope…
Bio-ethanol voor haard kopenBio-ethanol lijkt steeds meer de plaats van hout in te nemen als brandstof voor in de open haard. Veel Nederlanders kope…
 Massapercentage berekenen - theorie en voorbeeldenIn de scheikunde moeten veel dingen worden berekend: de E-factor, de hoeveelheid mol of een percentage. Vaak zijn zulke…
Massapercentage berekenen - theorie en voorbeeldenIn de scheikunde moeten veel dingen worden berekend: de E-factor, de hoeveelheid mol of een percentage. Vaak zijn zulke…
 Galvanische cel versus elektrolytische celEen galvanische en een elektrolytische cel zijn beiden gebaseerd op redoxreacties waarvan beide halfreacties doorgaan in…
Galvanische cel versus elektrolytische celEen galvanische en een elektrolytische cel zijn beiden gebaseerd op redoxreacties waarvan beide halfreacties doorgaan in…
 Normaliteit in verschillende chemische contextenDe normaliteit van een oplossing is de molaire concentratie (c(mol/L)) gedeeld door een equivalentiefactor f. Deze equiv…
Normaliteit in verschillende chemische contextenDe normaliteit van een oplossing is de molaire concentratie (c(mol/L)) gedeeld door een equivalentiefactor f. Deze equiv…
Gerelateerde artikelen
BiobrandstoffenDe wereld zoals we die nu kennen is sterk afhankelijk van de fossiele brandstoffen. Nu deze langzaam maar zeker opraken…
Bronnen en referenties
- Inleidingsfoto: OpenClipart-Vectors, Pixabay (bewerkt)
- Afbeelding bron 1: OpenClipart Vectors, Pixabay
Guust2016 (74 artikelen)
Laatste update: 16-04-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Laatste update: 16-04-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.