Bepaling van normpotentialen
 Elke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is een maat voor het oxiderend en reducerend vermogen van respectievelijk de oxidator en de reductor van dit koppel. Normpotentialen zijn terug te vinden in tabellen. Maar ooit heeft men deze tabellen moeten opstellen.
Elke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is een maat voor het oxiderend en reducerend vermogen van respectievelijk de oxidator en de reductor van dit koppel. Normpotentialen zijn terug te vinden in tabellen. Maar ooit heeft men deze tabellen moeten opstellen.
- Redoxreacties
- Normpotentialen
- De bepaling van een normpotentiaal
- Voorbeeld 1: de bepaling van de normpotentiaal van het redoxkoppel Zn2+/Zn
- Voorbeeld 2: de bepaling van de normpotentiaal van het redoxkoppel Cu2+/Cu
Redoxreacties
Een redoxreactie is een reactie waarbij een oxidator en een reductor elektronen uitwisselen. Een reductor geeft elektronen af en een oxidator neemt deze elektronen op. Je kan een redoxreactie opsplitsen in twee halfreacties (de oxidatie en de reductie) en je kan binnen een redoxreactie dus twee redoxkoppels beschouwen.Redoxkoppel 1 dat de oxidator levert: Ox1/Red1. Ox1 wordt dus zelf gereduceerd en omgezet in red1.
- Reductie: Ox1 + n e- → Red1
Redoxkoppel 2 dat de reductor levert : Ox2/Red2. Red2 wordt dus zelf geoxideerd en omgezet in ox2.
- Oxidatie: Red2 → Ox2 + m e-
Totale redoxreactie: m Ox1 + n Red2 → m Red1 + n Ox2
Normpotentialen
Elk redoxkoppel wordt gekenmerkt door een normpotentiaal. De waarde van de normpotentiaal geeft aan hoe sterk de oxidator of de reductor van een redoxkoppel is. Een hoge waarde wijst op een sterke oxidator en een lage waarde wijst op een sterke reductor.| Redoxkoppel | Normpotentiaal (E°) | |
|---|---|---|
| Ox1/Red1 | >0 | |
| 2H+/H2 | 0 | |
| Ox2/Red2 | <0 | |
Ox1 is een sterkere oxidator dan H+ en ox2.
Red2 is een sterkere reductor dan H2 en red1.
De bepaling van een normpotentiaal
Een normpotentiaal kan niet op zich worden gemeten. Een halfreactie kan niet opgaan zonder een tegenhalfreactie. Er kunnen immers geen elektronen in het niets verdwijnen of uit het niets verschijnen. Voor de bepalingen werd er 1 koppel gekozen om als referentiekoppel te dienen. Hiervoor werd het koppel H+/H2 gekozen. Aan dit koppel werd de normpotentiaal 0V toegewezen. Deze waarde werd dus niet gemeten, deze waarde werd gekozen. Om de normpotentialen van de andere koppels te bepalen, moeten deze dus rechtstreeks met het referentiekoppel in contact worden gebracht. Dit kan door met alle mogelijk redoxkoppels een galvanische cel te bouwen in combinatie met het referentiekoppel. In een galvanische cel worden twee redoxkoppels van elkaar gescheiden in twee compartimenten. Beide compartimenten worden met elkaar verbonden door een geleidende draad en een zoutbrug.De geleidende draad wordt in beide compartimenten verbonden met een elektrode. Binnen de schakeling kan ook een voltmeter worden geschakeld zodat de spanning U tussen beide compartimenten kan worden gemeten. De spanning geeft het potentiaalverschil tussen beide compartimenten. De elektrode die verbonden is met de positieve pool van de voltmeter, wordt de kathode genoemd. De andere elektrode, die verbonden is met de negatieve pool, is de anode.
- U = Ehoog – Elaag
- U = Ekathode(+) – Eanode(-)
- U = Eoxiderend systeem – Ereducerend systeem
Het oxiderend systeem is het koppel dat de oxidator levert. In dat compartiment gaat dus de reductie door. Het reducerend systeem is het koppel dat de reductor levert. In dat compartiment gaat dus de oxidatie door. De zoutbrug zorgt ervoor dat beide oplossingen elektrisch neutraal blijven. In een galvanische cel is het oxiderend systeem verbonden met de positieve pool van de voltmeter en het reducerend systeem met de negatieve pool. Indien de schakeling omgekeerd is, zal de voltmeter een negatieve waarde aangeven.
Voorbeeld 1: de bepaling van de normpotentiaal van het redoxkoppel Zn2+/Zn
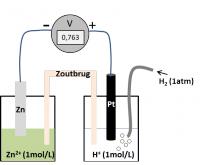
Je weet dus dat het waterstof-koppel het oxiderend systeem is en H+ gereduceerd wordt.
- Kathodische reductie: 2H+ + 2e- → H2
Verder weet je dat het zinken koppel het reducerend systeem is en Zn geoxideerd wordt.
- Anodische oxidatie: Zn → Zn2+ +2e-
U = 0.763 V = E°(2H+/H2) – E°(Zn2+/Zn)
Daar de normpotentiaal van het waterstofkoppel op 0 V werd vastgelegd, weet je uit de meting dat de E°(Zn2+/Zn) = -0.763 V
Voorbeeld 2: de bepaling van de normpotentiaal van het redoxkoppel Cu2+/Cu
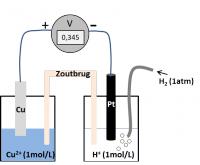
Je weet dus dat het koper-koppel het oxiderend systeem is en Cu2+ gereduceerd wordt.
- Kathodische reductie: Cu2+ + 2e- → Cu
Verder weet je dat het waterstof koppel het reducerend systeem is en H2 geoxideerd wordt.
- Anodische oxidatie: H2 → 2H+ + 2e-
U = 0.345 V = E°(Cu2+/Cu) – E° (2H+/H2)
Daar de normpotentiaal van het waterstofkoppel op 0 V werd vastgelegd, weet je uit de meting dat de E°(Cu2+/Cu) = 0.345V
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
 De sterkte van oxidatoren en reductorenRedoxreacties zijn reacties waarbij er elektronen worden uitgewisseld tussen een oxidator en een reductor. Niet alle oxi…
De sterkte van oxidatoren en reductorenRedoxreacties zijn reacties waarbij er elektronen worden uitgewisseld tussen een oxidator en een reductor. Niet alle oxi…
 Bleekwater en zure ontkalker, een gevaarlijke chloorcocktailBleekwater (of javel) bevat hypochlorietionen (ClO-) die als sterke oxidator fungeren t.o.v. kleurstoffen (bleekwater) e…
Bleekwater en zure ontkalker, een gevaarlijke chloorcocktailBleekwater (of javel) bevat hypochlorietionen (ClO-) die als sterke oxidator fungeren t.o.v. kleurstoffen (bleekwater) e…
 De werking van een lampje in een reddingsvestReddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden…
De werking van een lampje in een reddingsvestReddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden…
 De werking van een autobatterijDe batterij in een auto is een lood-accu. Deze batterij is nodig om de wagen te starten en om alles wat elektrische ener…
De werking van een autobatterijDe batterij in een auto is een lood-accu. Deze batterij is nodig om de wagen te starten en om alles wat elektrische ener…
 Galvanische cel versus elektrolytische celEen galvanische en een elektrolytische cel zijn beiden gebaseerd op redoxreacties waarvan beide halfreacties doorgaan in…
Galvanische cel versus elektrolytische celEen galvanische en een elektrolytische cel zijn beiden gebaseerd op redoxreacties waarvan beide halfreacties doorgaan in…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: PublicDomainPictures, Pixabay
Guust2016 (74 artikelen)
Laatste update: 08-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 1
Laatste update: 08-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 1
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.