Conductometrie als alternatief voor zuur-basetitraties
 Een conductometrische titratie is een volumetrische concentratiebepaling waarbij de geleidbaarheid van het reactiemengsel in functie van het volume toegevoegd titrant wordt gemeten. Deze waarden worden uitgezet in een titratiecurve. Als de te bepalen oplossing is weggereageerd, d.i. het equivalentiepunt (EP) van de titratie, dan zal de titratiecurve een knik vertonen wegens een veranderde evolutie in de geleidbaarheid van het reactiemengsel. Conductometrie is vooral geschikt om de concentratie van zuren en basen te bepalen. een eenvoudig alternatief voor de op pH gebaseerde zuur-basetitratie.
Een conductometrische titratie is een volumetrische concentratiebepaling waarbij de geleidbaarheid van het reactiemengsel in functie van het volume toegevoegd titrant wordt gemeten. Deze waarden worden uitgezet in een titratiecurve. Als de te bepalen oplossing is weggereageerd, d.i. het equivalentiepunt (EP) van de titratie, dan zal de titratiecurve een knik vertonen wegens een veranderde evolutie in de geleidbaarheid van het reactiemengsel. Conductometrie is vooral geschikt om de concentratie van zuren en basen te bepalen. een eenvoudig alternatief voor de op pH gebaseerde zuur-basetitratie.
- Geleidbaarheid van oplossingen
- Soortelijke (of specifieke) geleidbaarheid of conductiviteit
- Equivalente geleidbaarheid Λ
- Titratieopstelling
- Principe van de meting
- Uitgewerkte voorbeelden
- Titratie van een sterk zuur met een sterke base
- Titratie van een sterk zuur met een zwakke base
- Titratie van een zwak zuur met een sterke base
- Titratie van een zwak zuur met een zwakke base
- Conductmetrie bij neerslagreacties
Geleidbaarheid van oplossingen
Soortelijke (of specifieke) geleidbaarheid of conductiviteit
Een oplossing die elektrolyten bevat, dit zijn chemische stoffen welke in oplossing geheel of gedeeltelijk in ionen splitsen, zal elektrische stroom geleiden. Als er twee inerte platina elektroden, verbonden met een spanningsbron, in zo’n elektrolytische oplossing worden gebracht, dan zal er een elektrische stroom met een bepaalde sterkte (I) door de oplossing vloeien. De grootte van deze stroomsterkte is enerzijds afhankelijk van de grootte van de spanning (U) geleverd door de spanningsbron en anderzijds is deze ook afhankelijk van de weerstand (R) van de elektrolytische oplossing die zich tussen de twee elektroden bevindt.Net als bij metalen geleiders wordt ook voor elektrolytische oplossingen de relatie tussen de stroomsterkte, de spanning en de weerstand gegeven door de wet van Ohm.
I = U/R
met:
- R = weerstand tussen de 2 elektroden
- U = spanning
- I = stroomsterkte
Ook de wet van Pouillet is van toepassing voor elektrolytische oplossingen.
R = ρ × l/A
met
- R = weerstand tussen de 2 elektroden
- ρ = soortelijke (of specifieke) weerstand of resistiviteit, afhankelijk van de soort elektrolyt tussen de elektroden
- l = afstand tussen de elektroden in cm
- A = oppervlakte van de elektroden in cm2
De soortelijke of specifieke weerstand ρ (ohm/cm) is de weerstand van de elektrolytische oplossing die zich bevindt tussen 2 elektroden die elk een oppervlakte hebben van 1 cm2 en op 1 cm van elkaar zijn geplaatst.
De geleidbaarheid is het omgekeerde van de weerstand en heeft als eenheid Siemens (S)
G = 1/R
De soortelijke of specifieke geleidbaarheid κ (S.cm) is de omgekeerde waarde van de soortelijke weerstand of resistiviteit.
κ = 1/ρ
Equivalente geleidbaarheid Λ
De specifieke geleidbaarheid van een ion geldt voor het gehele ion maar omdat niet alle ionen dezelfde lading dragen, kunnen specifieke geleidbaarheden niet rechtstreeks met elkaar worden vergeleken. Bijvoorbeeld K+, Ca2+ en Al3+ hebben respectievelijk lading +1, +2 en +3. Daarom werd de equivalente geleidbaarheid ingevoerd. De equivalente geleidbaarheid is de specifieke geleidbaarheid wiskundig herleid naar een concentratie van 1 mol lading/L.Voorbeelden van equivalente geleidbaarheden
Stel een Na+-oplossing met een concentratie van 1 mol/L. 1 mol komt overeen met 6.023 ×1023 Na+-ionen. Een Na+-ion heeft lading +1. Een Na+-oplossing met een concentratie van 1 mol/l bevat dus ook 1 mol/L ladingen.
Stel een Ca2+-oplossing met een concentratie van 1 mol/L. Een Ca2+-ion heeft lading +2. Een Ca2+-oplossing met een concentratie van 1 mol/L bevat dus 2 mol/L ladingen.
De equivalente geleidbaarheid van een oplossing is dus de experimenteel bepaalde specifieke geleidbaarheid gedeeld door de concentratie aan ladingen in deze oplossing.
In volgende tabel worden de equivalente geleidbaarheden (geëxtrapoleerd naar oneindige verdunning) van de voornaamste kationen en anionen gegeven bij een temperatuur van 25 °C. Merk op dat men voor meerwaardige ionen een breuk plaatst om te benadrukken dat de eenheid van concentratie uitgedrukt wordt in mol lading per liter.
| Kation | Λ | Anion | Λ |
|---|---|---|---|
| Na+ | 50.8 | Cl- | 75.8 |
| K+ | 74.8 | Br- | 77.7 |
| Ag+ | 63.4 | I- | 73.0 |
| H+ | 250.0 | OH- | 198 |
| NH4+ | 74.9 | CH3COO- | 40.8 |
| Li+ | 41.7 | 1/2 SO42- | 80.0 |
| 1/2 Mg2+ | 55.0 | ClO3- | 63.3 |
| 1/2 Ba2+ | 65.2 | NO3- | 71.4 |
| 1/2 Ca2+ | 61.0 | BrO3- | 55.3 |
| 1/2 Pb2+ | 71.0 | IO3- | 39.6 |
| 1/2 Ni2+ | 53.6 | 1/2 C2O42- | 73.5 |
| 1/2 Fe2+ | 54.0 | 1/3 Fe(CN)63- | 97.3 |
| 1/3 Fe3+ | 68.4 | 1/4 Fe(CN)64- | 100.8 |
| 1/3 La3+ | 69.6 | 1/2 CO3- | 69.3 |
De equivalente geleidbaarheid is een maat voor de capaciteit van een ion om stroom te vervoeren. Stel bijvoorbeeld een oplossing van kaliumchloride (KCl). KCl is in oplossing volledig gesplitst in K+- en Cl--ionen. Beide ionen hebben een vergelijkbare equivalente geleidbaarheid namelijk 74.8 en 75.8. K+ en Cl- zullen in deze oplossing dus ongeveer even verantwoordelijk zijn voor de geleidbaarheid van de oplossing.
Maar stel een zoutzuur-oplossing (HCl). In oplossing is HCl volledig opgesplitst in H+- en Cl--ionen. Nu zal de geleidingsbijdrage van beide ionen sterk verschillen. H+-ionen hebben immers en veel hogere equivalente geleidbaarheid (250.0) dan Cl--ionen (75.8).
Titratieopstelling
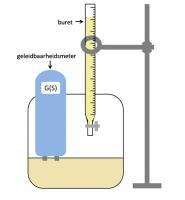 Titratieopstelling
TitratieopstellingPrincipe van de meting
Een conductometrische titratie is vooral geschikt om de concentratie van zuren en basen te bepalen daar H-- en OH--ionen een grote equivalente geleidbaarheid vertonen namelijk 250.0 en 198. Een verandering in de concentratie van deze ionen resulteert dus in een grote verandering van de geleidbaarheid van het reactiemengsel. De titratiecurven geven dus een duidelijke evolutieverandering bij het equivalentiepunt.Uitgewerkte voorbeelden
Titratie van een sterk zuur met een sterke base
Bepaling van de concentratie van een HCl-oplossing door titratie met een NaOH-oplossing met gekende concentratieVoor deze titratie wordt een bepaald volume (VHCl) van de ongekende HCl-oplossing in het bekerglas gebracht en de NaOH-oplossing met gekende concentratie (cNaOH) in de buret.
De titratiereactie: HCl + NaOH → H2O + NaCl
Omdat HCl en NaCl in oplossing volledig als ionen voorkomen, kan de titratiereactie ook als volgt worden genoteerd.
De titratiereactie in ionvorm: H+ + Cl- + Na+ + OH- → H2O + Na+ + Cl-
Voor het equivalentiepunt (EP) zijn volgende ionen aanwezig in de beker: H+, Cl- en Na+. Er zijn geen OH--ionen aanwezig omdat deze wegreageren met de aanwezige H+-ionen.
- H+: De concentratie zal dalen tijdens de titratie want H+ reageert weg met het toegevoegde OH-.
- Cl-: Tijdens de titratie zal er met dit ion niets gebeuren waardoor de concentratie aan dit ion constant blijft.
- Na+: De concentratie aan dit ion zal toenemen daar het samen met OH- wordt toegevoegd en niet wegreageert.
Voor het EP zal de concentratie aan H+-ionen dus dalen en de concentratie aan Na+-ionen toenemen. Omdat H+-ionen een veel hogere equivalente geleidbaarheid hebben dan Na+-ionen, zal de geleidbaarheid van het reactiemengsel tijdens het titreren dus duidelijk afnemen.
Bij het EP zullen alle H+-ionen zijn weggereageerd.
Na het EP zijn volgende ionen aanwezig in de beker: Na+, OH- en Cl-. Er zijn geen H+-ionen meer aanwezig daar deze allen zijn weggereageerd. Er zijn na het EP nu wel OH--ionen aanwezig omdat er geen H+-ionen meer aanwezig zijn waarmee de toegevoegde OH--ionen kunnen reageren.
- Na+: De concentratie aan dit ion zal stijgen want ze worden nog steeds toegevoegd samen met de OH--ionen en reageren niet weg.
- Cl-: De concentratie blijft ook na het EP constant omdat de Cl--ionen niet reageren en niet extra worden toegevoegd.
- OH-: De concentratie aan dit ion stijgt daar OH- nu niet meer weg kan reageren.
Zowel de concentratie aan Na+ als de concentratie aan OH--ionen zal dus stijgen wat resulteert in een stijging van de geleidbaarheid van het reactiemengsel in de beker.
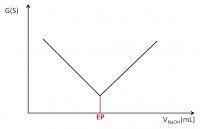 Titratie van een sterk zuur met een sterke base
Titratie van een sterk zuur met een sterke basecHCl = (cNaOH × VNaOH) / VHCl
Titratie van een sterk zuur met een zwakke base
Bepaling van de concentratie van een HCl-oplossing door titratie met een NH4OH-oplossing met gekende concentratieNH4OH is een waterige oplossing van NH3: NH3 + H2O → NH4OH
Voor deze titratie wordt een bepaald volume van een ongekende HCl-oplossing (VHCl) in het bekerglas gebracht en de NH4OH-oplossing met gekende concentratie (cNH4OH) in de buret.
De titratiereactie: HCl + NH4OH → H2O + NH4Cl
HCl zal volledig als ionen in de oplossing voorkomen terwijl NH4OH slechts weinig tot niet ioniseert. NH4Cl valt wel gemakkelijk uit elkaar in ionen.
De titratiereactie in ionvorm: H+ + Cl- + NH4OH-→ H2O + NH4+ + Cl-
Voor het EP zijn volgende ionen aanwezig: H+, Cl- en NH4+. Er zijn geen OH--ionen aanwezig omdat deze wegreageren met de aanwezige H+-ionen in de beker.
- H+: De concentratie zal dalen tijdens de titratie want H+ reageert weg met het toegevoegde OH- van NH4OH.
- Cl-: De concentratie aan dit ion zal constant blijven tijdens de titratie want het blijft ongewijzigd in het reactiemengsel.
- NH4+: De concentratie zal toenemen daar het samen met de OH- wordt toegevoegd en niet reageert.
Voor het EP zal de concentratie aan H+-ionen dus dalen en de concentratie aan NH4+-ionen toenemen. Omdat H+-ionen een veel hogere equivalente geleidbaarheid hebben dan NH4+-ionen, zal de geleidbaarheid van het reactiemengsel afnemen.
Bij het EP zullen alle H+-ionen zijn weggereageerd.
Na het EP is vooral volgend ion aanwezig in de beker: Cl-. Er zijn geen H+-ionen meer aanwezig daar deze allen zijn weggereageerd. Er is nu ook een overmaat NH4OH aanwezig maar deze zal dus weinig tot niet ioniseren.
- Cl-: De concentratie blijft ook na het EP constant omdat de Cl--ionen niet reageren en ook niet worden toegevoegd.
- NH4OH: De concentratie aan deze verbinding zal stijgen maar omdat deze stof weinig tot niet ioniseert, zal dit weinig tot niks veranderen aan de geleidbaarheid van het reactiemengsel.
Er zijn na het EP dus geen ionen die een beduidende stijging in concentratie kennen.
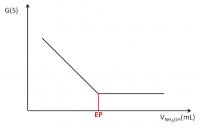 Titratie van een sterk zuur met een zwakke base
Titratie van een sterk zuur met een zwakke basecHCl = (cNH4OH × VNH4OH) / VHCl
Titratie van een zwak zuur met een sterke base
Bepaling van de concentratie van een CH3COOH-oplossing door titratie met een NaOH-oplossing met gekende concentratieVoor deze titratie wordt een bepaald volume van de ongekende CH3COOH-oplossing (VCH3COOH) in het bekerglas gebracht en de NaOH-oplossing met gekende concentratie (cNaOH) in de buret.
De titratiereactie: CH3COOH + NaOH → H2O + CH3COONa
Daar CH3COOH een zwak zuur is, zal dit maar beperkt ioniseren:
CH3COOH ← CH3COO- + H+
De titratiereactie in ionvorm: CH3COOH + (CH3COO- + H+) + Na+ + OH- → CH3COO- + Na+ + H2O
Er zal aan het begin dus slechts een kleine hoeveelheid CH3COO- en H+ aanwezig zijn.
Voor het EP zijn volgende ionen aanwezig: H+, CH3COO- en Na+. Er zijn geen OH--ionen aanwezig. Deze zullen aan het begin van de titratie wegreageren met de aanwezig H+-ionen en zullen bij het verdere verloop van de titratie rechtstreeks H+-ionen afnemen van CH3COOH.
- H+: De kleine hoeveelheid die in het begin aanwezig is, zal onmiddellijk volledig wegreageren.
- Na+: De concentratie zal stijgen, daar deze ionen worden toegevoegd samen met de OH--ionen en niet reageren.
- CH3COO-: De concentratie aan dit ion zal stijgen daar dit wordt gevormd tijdens de titratiereactie.
Voor het EP zal de kleine hoeveelheid aanwezige H+-ionen dus onmiddellijk wegreageren, wat de kleine daling aan het begin van de titratiecurve verklaart. Vervolgens zal de geleidbaarheid van het reactiemengsel stijgen daar de concentraties van zowel de Na+-ionen als de CH3COO--ionen stijgen.
Bij het EP zal al het CH3COOH zijn weggereageerd.
Na het EP zijn volgende ionen aanwezig in de beker Na+, CH3COO- en OH-.
- Na+: De concentratie blijft ook na het EP stijgen daar het blijft worden toegevoegd en het niet reageert.
- CH3COO-: De concentratie aan deze verbinding zal na het EP constant blijven omdat er geen CH3COOH meer is waaruit dit ion kan worden gevormd.
- OH-: De concentratie stijgt omdat er geen CH3COOH meer is om mee te reageren.
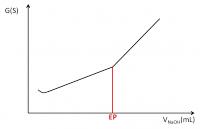 Titratie van een zwak zuur met een sterke base
Titratie van een zwak zuur met een sterke basecCH3COOH = (cNaOH × VNaOH) / VCH3COOH
Titratie van een zwak zuur met een zwakke base
Bepaling van de concentratie van een CH3COOH-oplossing door titratie met een NH4OH-oplossing met gekende concentratieVoor deze titratie wordt een bepaald volume van de ongekende CH3COOH-oplossing (VCH3COOH) in het bekerglas gebracht en de NH4OH-oplossing met gekende concentratie (cNH4OH) in de buret.
De titratiereactie: CH3COOH + NH4OH → H2O + CH3COONH4
Net als in voorbeeld 2 en voorbeeld 3 vermeld, komen CH3COOH en NH4OH voor als weinig tot niet geïoniseerde verbindingen.
De titratiereactie in ionvorm: CH3COOH + (CH3COO- + H+) + NH4OH → CH3COO- + NH4+ + H2O
H+: De kleine hoeveelheid die in het begin aanwezig is, zal onmiddellijk volledig wegreageren wat hier ook resulteert in een kleine afname van de geleidbaarheid bij de aanvang van de titratie.
Voor het EP zijn volgende ionen aanwezig in de beker: NH4+ en CH3COO-.
- NH4+: De concentratie aan dit ion zal stijgen, daar deze ionen worden toegevoegd samen met de OH--ionen welke telkens wegreageren.
- CH3COO-: De concentratie aan dit ion zal stijgen daar dit wordt gevormd tijdens de titratiereactie.
Voor het EP zal buiten de kleine afname in het begin van de titratie de geleidbaarheid van het reactiemengsel stijgen daar de concentraties van zowel NH4+ als CH3COO- stijgen.
Bij het EP zal al het CH3COOH zijn weggereageerd.
Na het EP zijn nog steeds dezelfde ionen aanwezig in de beker: NH4+ en CH3COO-.
- NH4+: De concentratie blijft ook na het EP constant. De extra NH4OH die zal worden toegevoegd, blijft onveranderd daar er geen CH3COOH meer aanwezig is om mee te reageren.
- CH3COO-: Ook van dit ion zal de concentratie constant blijven daar er geen CH3COOH meer aanwezig is om extra CH3COO- te vormen
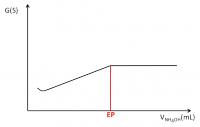 Titratie van een zwak zuur met een zwakke base
Titratie van een zwak zuur met een zwakke basecCH3COOH = (cNH4OH × VNH4OH) / VCH3COOH
Conductmetrie bij neerslagreacties
Conductometrische methoden gebaseerd op neerslagreacties zijn weinig nauwkeurig en dus niet zo bruikbaar als die waarbij zuur-basereacties betrokken zijn. Dit komt omdat de veranderingen in geleidbaarheid bij neerslagtitraties niet zo groot zijn als deze die men kan waarnemen bij zuur-basetitraties. Immers, er zijn geen andere ionen die de geleidbaarheid van H+-ionen en OH--ionen benaderen.© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Titratiecurven in Excel: zwak zuur met sterke baseTitratiecurven geven een goed inzicht in de verandering van de pH tijdens de titratie. Rondom het equivalentiepunt treed…
Titratiecurven in Excel: zwak zuur met sterke baseTitratiecurven geven een goed inzicht in de verandering van de pH tijdens de titratie. Rondom het equivalentiepunt treed…
 Titratiecurven in Excel: sterk zuur met sterke baseBij de titratie van een zuur met een base is het equivalentiepunt zichtbaar te maken met een indicator. Dat komt omdat i…
Titratiecurven in Excel: sterk zuur met sterke baseBij de titratie van een zuur met een base is het equivalentiepunt zichtbaar te maken met een indicator. Dat komt omdat i…
 De werking van een redoxindicatorOm het equivalentiepunt bij een redoxtitratie met kleurloze of weinig gekleurde oplossingen te kunnen zien, dient een re…
De werking van een redoxindicatorOm het equivalentiepunt bij een redoxtitratie met kleurloze of weinig gekleurde oplossingen te kunnen zien, dient een re…
 Jodo-jodimetrie, een veelzijdige techniekJodo-jodimetrie is een redoxmethode gebaseerd op titrimetrie. De methode kan worden gebruikt voor tal van toepassingen w…
Jodo-jodimetrie, een veelzijdige techniekJodo-jodimetrie is een redoxmethode gebaseerd op titrimetrie. De methode kan worden gebruikt voor tal van toepassingen w…
 Benzeen versus cyclohexeen en cyclohexa-1,4-dieenDe systematische naam van benzeen is cyclohexa-1,3,5-trieen en deze verbinding lijkt wat betreft de moleculaire structuu…
Benzeen versus cyclohexeen en cyclohexa-1,4-dieenDe systematische naam van benzeen is cyclohexa-1,3,5-trieen en deze verbinding lijkt wat betreft de moleculaire structuu…
 Absorptie en emissie door elektronenNiels Bohr was een Deens wetenschapper die aan het begin van de 20ste eeuw een verband legde tussen de kleureffecten bij…
Absorptie en emissie door elektronenNiels Bohr was een Deens wetenschapper die aan het begin van de 20ste eeuw een verband legde tussen de kleureffecten bij…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: OpenClipart-Vectors, Pixabay
- Binas, R. Brouwens, P. de Groot en W. Kranendonk
Guust2016 (74 artikelen)
Gepubliceerd: 19-05-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Gepubliceerd: 19-05-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.