Chromatografie: technieken en types
 Chromatografie betekent letterlijk schrijven met kleuren. Een binnen de scheikunde bekend en heel eenvoudig voorbeeldje is dan ook het scheiden met behulp van papierchromatografie van de inkt uit een viltstift in zijn samenstellende kleurpigmenten. Chromatografie is echter een veelzijdige techniek die kan worden aangewend voor tal van scheidingen. Het principe van de scheiding is voor elk type chromatografie hetzelfde. Het te scheiden mengsel wordt via een mobiele fase langs een stationaire fase bewogen. De mobiele fase kan gasvormig of vloeibaar zijn en de stationaire fase is een vloeistof of een vaste stof. De componenten van een mengsel kunnen op deze manier worden gescheiden indien de componenten niet even goed worden tegengehouden door de stationaire fase. Afhankelijk van het type chromatografie, kunnen stoffen van elkaar worden gescheiden die verschillen vertonen in oplosbaarheid in een bepaalde stof, in affiniteit voor een bepaalde stof, in grootte of in lading.
Chromatografie betekent letterlijk schrijven met kleuren. Een binnen de scheikunde bekend en heel eenvoudig voorbeeldje is dan ook het scheiden met behulp van papierchromatografie van de inkt uit een viltstift in zijn samenstellende kleurpigmenten. Chromatografie is echter een veelzijdige techniek die kan worden aangewend voor tal van scheidingen. Het principe van de scheiding is voor elk type chromatografie hetzelfde. Het te scheiden mengsel wordt via een mobiele fase langs een stationaire fase bewogen. De mobiele fase kan gasvormig of vloeibaar zijn en de stationaire fase is een vloeistof of een vaste stof. De componenten van een mengsel kunnen op deze manier worden gescheiden indien de componenten niet even goed worden tegengehouden door de stationaire fase. Afhankelijk van het type chromatografie, kunnen stoffen van elkaar worden gescheiden die verschillen vertonen in oplosbaarheid in een bepaalde stof, in affiniteit voor een bepaalde stof, in grootte of in lading.
- Technieken: kolomchromatografie en dunnelaagchromatografie
- Chromatografietypen en de drijvende kracht achter hun scheidingsmethode
- Chromatografietype op basis van oplosbaarheid
- Chromatografietypen op basis van affiniteit: Vanderwaalsinteractie, dipoolinteractie of waterstofbruggen
- Chromatografietypen op basis van affiniteit: elektrostatische interactie
- Chromatografietype op basis van grootte
- Chromatografietype op basis van lading
Technieken: kolomchromatografie en dunnelaagchromatografie
Chromatografie kan op twee manieren gebeuren: via kolomchromatografie en via dunnelaagchromatografie (TLC). Bij kolomchromatografie wordt de stationaire fase in een kolom gebracht en laat men de mobiele fase door de kolom stromen. Bij dunnelaagchromatografie wordt de stationaire fase op een plaatje gebracht en laat men de mobiele fase via capillariteit opwaarts het plaatje stromen. De aggregatietoestand van de stationaire en de mobiele fase is afhankelijk van de techniek en het type chromatografie. In onderstaande tabel staan de mogelijke combinaties mobiel/stationair.| Techniek | Kolomchromatografie | Dunnelaagchromatografie | ||
|---|---|---|---|---|
| mogelijkheid 1 | mogelijkheid 2 | mogelijkheid 3 | ||
| Aggregatietoestand mobiele fase | vloeibaar | gas | gas | vloeibaar |
| Aggregatietoestand stationaire fase | vast | vast | vloeibaar | vast |
Chromatografietypen en de drijvende kracht achter hun scheidingsmethode
Elk soort mengsel vraagt voor zijn scheiding een bepaald type chromatografie. Componenten in een mengsel kunnen worden gescheiden op basis van hun oplosbaarheid in een bepaalde (vloeibare) stationaire fase, op basis van hun affiniteit t.o.v. een bepaalde (vaste) stationaire fase, op basis van hun grootte (massa) en op basis van hun lading en dit meestal in combinatie met hun grootte (massa).Chromatografietype op basis van oplosbaarheid
Hierbij is de scheiding van stoffen gebaseerd op hoe goed de stoffen oplossen in een bepaalde vloeibare stationaire fase. Hiervoor moet het te scheiden mengsel een gas zijn of moeten de componenten van het mengsel in de gasfase kunnen worden gebracht.GLC (Gas Liquid Chromatography)
Bij GLC wordt de vloeibare stationaire fase als een film in een capillaire kolom gebracht. Deze vloeistof moet een hoog kookpunt hebben daar deze stationaire fase uiteraard niet mee mag verdampen met de te scheiden stoffen. Als mobiele fase wordt een gas gebruikt dat het te scheiden mengsel door de kolom voert. Vaak wordt hiervoor waterstofgas (H2), stikstofgas (N2), Argon of Helium gebruikt. De te scheiden componenten moeten dus gassen zijn of moeten vluchtig zijn daar ze als gas door de kolom moeten kunnen meebewegen met de gasvormige mobiele fase.
Om een apolair, polair of aromatisch mengsel te scheiden, dient respectievelijk een apolaire, polaire of aromatische stationaire fase te worden gebruikt. De componenten moeten immers oplossen in de stationaire fase om scheiding te kunnen verkrijgen. Indien de componenten geen oplosbaarheid in de stationaire fase vertonen, zullen zij allen gewoon als gas samen met de mobiele fase de kolom doorlopen en allen samen de kolom verlaten.
Voorbeelden
| Te scheiden mengsel | Geschikte stationaire fase |
|---|---|
| Koolwaterstoffen (gassen) | dimethylsulfolaan |
| Vluchtige koolwaterstoffen | Squalaan |
| Aromatische koolwaterstoffen | Polyfenylether |
| Alcoholen en aminen | Polyethyleenglycol |
Chromatografietypen op basis van affiniteit: Vanderwaalsinteractie, dipoolinteractie of waterstofbruggen
Hierbij is de scheiding van stoffen gebaseerd op hoe goed stoffen geadsorbeerd (aangehecht) worden aan een vaste stationaire fase. Het te scheiden mengsel kan een gasmengsel of een vloeibaar mengsel zijn. Adsorptie kan optreden indien de te scheiden componenten kunnen worden vastgehouden door de stationaire fase via intermoleculaire interacties zoals Vanderwaalsinteracties, dipoolinteracties en/of waterstofbruggen.Voorbeelden van stationaire fasen in volgorde van stijgende adsorptiesterkte
zetmeel < talk < CaCO3 < SiO2 (silica) < Al2O3 (alumina) < actieve kool < MgO < kleisoorten
Voorbeelden van mobiele fasen in volgorde van stijgende polariteit
petroleumether < cyclohexaan < tolueen < chloroform < diëthylether < ethylacetaat < aceton < propanol < ethanol< water
Welke mobiele en stationaire fase kies je voor een bepaald te scheiden mengsel?
De keuze van de stationaire en mobiele fase hangt af van de polariteit van het te scheiden mengsel. Voor polaire mengsels kiest men best een polaire stationaire alsook een polaire mobiele fase. Voor een apolair mengsel zijn beide fasen best ook apolair. Indien je bij een polair mengsel bijvoorbeeld een polaire mobiele fase en een apolaire stationaire fase kiest, dan zal het mengsel niet door de stationaire fase worden tegengehouden en zullen alle samenstellende componenten gemakkelijk meevloeien met de mobiele fase. Er zal dus geen goede scheiding kunnen optreden. Indien je voor een polair mengsel zou kiezen voor een polaire stationaire fase en een apolaire mobiele fase, dan zouden de samenstellende componenten zeer goed worden vastgehouden door de stationaire fase en zou er ook hier een slechte scheiding optreden die bovendien enorm lang zou duren.
HPLC (High Performance Liquid Chromatography)
Bij deze techniek is de stationaire fase vast en de mobiele fase vloeibaar. Terwijl bij gewone kolomchromatografie het mengsel en de mobiele fase onder invloed van de zwaartekracht doorheen de kolom bewegen, zullen bij HPLC de componenten onder druk door de kolom worden bewogen. Hierdoor kan de scheiding worden geoptimaliseerd. Een goede scheiding vraagt een kleine korrelgrootte van de stationaire fase. Kleinere korrels zorgen immers voor een groter contactoppervlak met de te scheiden componenten. Ook een langere kolom verhoogt het scheidingsvermogen. De componenten krijgen hierdoor immers de kans om volledig uit elkaar te gaan en dus beter te scheiden. Een kleine korrelgrootte en een lange kolom verlengen echter de analysetijd. Deze analysetijd kan verlaagd worden door onder druk te werken.
TLC (Thin Layer Chromatography)
Bij TLC of dunnelaagchromatografie bestaat de stationaire fase uit een vaste stof gehecht op een drager. Als mobiele fase wordt een vloeistof gebruikt. Ook papierchromatografie waarbij het papier de stationaire fase vormt, is een vorm van TLC.
GSC (Gas Solid Chromatography)
Deze techniek lijkt op GLC met het verschil dat de stationaire fase hier een vaste stof is. In tegenstelling tot een capillaire kolom wordt hier gebruik gemaakt van gepackte kolommen. Om gebruik te kunnen maken van de adsorberende eigenschappen van de vaste stationaire fase moet deze eerst geactiveerd worden door ze te drogen in een droogstoof. Als de stationaire fase helemaal geactiveerd is, vindt de opdeling enkel plaats door adsorptie. Zulke actieve adsorptiemiddelen worden echter zeer snel gedeactiveerd aan de lucht door opname van water. In dat geval spelen bij de scheiding zowel adsorptie als oplosbaarheid een rol.
Chromatografietypen op basis van affiniteit: elektrostatische interactie
IonenuitwisselingschromatografieVoor ionenuitwisselingschromatografie gebruikt men als stationaire fase een hars bestaande uit kationen- en/of anionenwisselaars. Bij deze methode treedt er een elektrostatische interactie op tussen de stationaire fase en de uit te wisselen ionen.
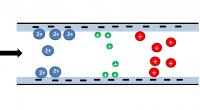
Dit type chromatografie kan bijvoorbeeld worden gebruikt om water te verzachten (verwijderen van Ca- en Mg-ionen) of water te demineraliseren (verwijderen van alle ionen).
Chromatografietype op basis van grootte
Met deze techniek worden componenten van elkaar gescheiden op basis van grootte of massa.Gelpermeatiechromatografie
Gelpermeatiechromatografie kan worden gebruikt om na te gaan wat de verdeling van de molaire massa’s in een staal is. Dit wordt dan ook vooral gebruikt in de polymeerindustrie. Het is immers niet mogelijk om polymeren te synthetiseren die allen exact dezelfde ketenlengte hebben. We spreken bij polymeren dan over een polymeerverdeling. Deze verdeling kan onderzocht worden door het polymeermengsel aan gelpermeatiechromatografie te onderwerpen. Bovendien kunnen door deze scheiding nieuwe mengsels worden verkregen met een nauwere polymeerverdeling.
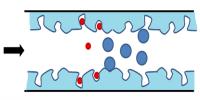
Chromatografietype op basis van lading
Componenten met een verschillende lading kunnen in een elektrisch veld van elkaar worden gescheiden.Elektroforese
Bij elektroforese wordt het te scheiden mengsel aangebracht op een drager (papier, agar...). Vervolgens wordt er een spanningsverschil over de drager aangebracht met behulp van een gelijkspanningsbron. Hierdoor zullen de verschillende componenten van elkaar gescheiden worden op basis van hun lading en hun grootte.
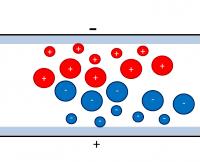
Deze methode wordt gebruikt om aminozuren en eiwitten te scheiden en wordt ook toegepast bij DNA-onderzoek.
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Kolomchromatografie versus dunnelaagchromatografieChromatografie is een scheidingstechniek gebaseerd op een opdeling van stoffen over twee niet-mengbare fasen. Deze twee…
Kolomchromatografie versus dunnelaagchromatografieChromatografie is een scheidingstechniek gebaseerd op een opdeling van stoffen over twee niet-mengbare fasen. Deze twee…
 Scheidingsmethoden binnen de scheikundeIn de scheikunde spreken we van een mengsel als een stof meer dan twee soorten deeltjes bevat. Een zuivere stof bestaat…
Scheidingsmethoden binnen de scheikundeIn de scheikunde spreken we van een mengsel als een stof meer dan twee soorten deeltjes bevat. Een zuivere stof bestaat…
 Het iso-elektrisch punt van een aminozuurHet iso-elektrisch punt van een aminozuur is de pH (zuurtegraad) waarbij dit aminozuur niet onderhevig is aan een elektr…
Het iso-elektrisch punt van een aminozuurHet iso-elektrisch punt van een aminozuur is de pH (zuurtegraad) waarbij dit aminozuur niet onderhevig is aan een elektr…
 Wat als meerdere Lewisstructuurformules mogelijk zijn?Alhoewel er een duidelijk stappenplan is om een Lewisstructuurformule op stellen, gebeurt het soms dat er voor een bepaa…
Wat als meerdere Lewisstructuurformules mogelijk zijn?Alhoewel er een duidelijk stappenplan is om een Lewisstructuurformule op stellen, gebeurt het soms dat er voor een bepaa…
Gerelateerde artikelen
PapierchromatografieChromatografie is de verzamelnaam voor een aantal scheidingstechnieken. Deze technieken berusten allemaal op het princip…
Chromatografie, wat is het?Wat is chromatografie? Het klinkt heel moeilijk maar het principe is vrij simpel. Ik zal uitleggen wat het is en wat de…
Bronnen en referenties
- Inleidingsfoto: MasterTux, Pixabay
- Analytische scheikunde 2, W. Biermans, A. Pyra en F. Schuyten
- Fundamentals of analytical chemistry, Skoog, West en Holler.
Guust2016 (74 artikelen)
Gepubliceerd: 17-06-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Gepubliceerd: 17-06-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.