De werking van een zuur-base-indicator
 Zuur-base-indicatoren zijn organische zuren of basen waarvan de zure en de basische vorm een andere kleur heeft. De zuurtegraad waarbij de kleur van een zuur-base-indicator verandert, is eigen aan elke indicator. Met een zuur-base-indicator kan je dus aantonen of de pH van een oplossing hoger of lager is dan een bepaalde waarde. Door verschillende zuur-base-indicatoren te combineren kan je een goede richtwaarde van de heersende pH verkrijgen.
Zuur-base-indicatoren zijn organische zuren of basen waarvan de zure en de basische vorm een andere kleur heeft. De zuurtegraad waarbij de kleur van een zuur-base-indicator verandert, is eigen aan elke indicator. Met een zuur-base-indicator kan je dus aantonen of de pH van een oplossing hoger of lager is dan een bepaalde waarde. Door verschillende zuur-base-indicatoren te combineren kan je een goede richtwaarde van de heersende pH verkrijgen.
- Chemisch gedrag van een zuur-base-indicator
- De evenwichtsconstante van een zuur-base-indicator
- Voorbeeld van een zure zuur-base-indicator (fenolftaleïne)
- Voorbeeld van een basische zuur-base-indicator (methylrood)
- Het omslaggebied van de indicator
- Mengindicatoren
- Universeel indicator
Chemisch gedrag van een zuur-base-indicator
Algemeen kan je een zuur-base-indicator voorstellen als HInd of Ind- waarbij HInd de zure vorm van de indicator voorstelt en Ind- de basische vorm. Voor elke indicator zijn beide vormen met elkaar in evenwicht. De zure vorm van de indicator wordt door het afgeven van een proton (H+) omgezet in de basische vorm. Afhankelijk van de zuurtegraad van de oplossing waarin de indicator zich bevindt, zullen er meer of minder indicatormoleculen de zure of basische vorm aannemen.HInd ↔ H+ + Ind-
- Door de pH van de oplossing te verlagen (aanzuren) zal het evenwicht naar links verschuiven. Tijdens het aanzuren zullen immers protonen worden toegevoegd aan de oplossing welke kunnen worden opgenomen door Ind--moleculen. Het aanzuren heeft dus als gevolg dat er meer HInd dan Ind- aanwezig is.
- Door de pH van de oplossing te verhogen en er dus protonen uit de oplossing zullen verdwijnen, zal het evenwicht naar rechts verschuiven en zal de oplossing dus meer Ind- dan HInd bevatten.
De evenwichtsconstante van een zuur-base-indicator
De kleur die de indicatoroplossing zal aannemen, is afhankelijk van de verhouding tussen de HInd- en de Ind--deeltjes. Indien er meer HInd aanwezig is, zal de kleur van HInd overheersen op de kleur van Ind- en omgekeerd.De pH waarbij HInd of Ind- overheerst, hangt af van de specifieke indicator. Bij elke indicator ligt het evenwicht tussen HInd en Ind- immers anders. Voor elke indicator wordt het evenwicht gekarakteriseerd door een welbepaalde evenwichtsconstante.
KInd = (cH+ × cInd-) /cHInd
met:
- cH+= de concentratie aan protonen
- cInd- = de concentratie aan Ind-
- cHInd = de concentratie aan HInd
Bij een indicator met een hoge evenwichtsconstante, zal het evenwicht dus sterk naar rechts liggen. Bij een indicator met een lage evenwichtsconstante, ligt het evenwicht meer naar links.
Als er evenveel HInd- en Ind--deeltjes in de oplossing aanwezig zijn, dan zal de oplossing een mengkleur vertonen.
- cHInd = cInd-
- KInd = cH+ of pH = pKInd (met p = -log)
Bij deze pH vindt het omslagpunt van de indicator plaats. Anders gezegd, bij deze pH verandert de kleur van de indicatoroplossing.
Voorbeeld van een zure zuur-base-indicator (fenolftaleïne)
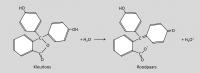
Fenolftaleïne heeft een KInd = 6.31 × 10-10 of een pKInd = 9.2. Bij een pH lager dan 9.2 is de zure fenolftaleïnevorm dus meer aanwezig dan de basische fenolftaleïnevorm. Er zijn dus meer kleurloze deeltjes aanwezig dan roodpaarsgekleurde. Bij een pH boven 9.2 is het omgekeerde het geval. pH = 9.2 is het omslagpunt van fenolftaleïne.
Voorbeeld van een basische zuur-base-indicator (methylrood)
Methylrood heeft een KInd = 1.12 × 10-5 of een pKInd = 4.95. Bij een pH lager dan 4.95 is de zure methylroodvorm dus meer aanwezig dan de basische methylroodvorm. Er zijn dus meer rode deeltjes aanwezig dan geel gekleurde. Bij een pH van boven 4.95 is het omgekeerde het geval. pH = 4.95 is het omslagpunt van methylrood.
Het omslaggebied van de indicator
Net voor het omslagpunt is er dus 1 zuur deeltje meer aanwezig en na het omslagpunt is er 1 basisch deeltje in de meerderheid. Dit kan het menselijk oog uiteraard niet waarnemen. Er zal voor een bepaald pH-interval een mengkleur worden waargenomen.Gemiddeld gezien kan een menselijk oog wel het volgende waarnemen: de zure kleur van de indicator kan worden waargenomen als er 10 keer meer zure dan basische deeltjes aanwezig zijn.
- cHInd = 10 cInd-
- cH+ = KInd × cHInd/cInd-
De zure kleur van de indicator zal dus worden waargenomen bij:
- cH+ > KInd × 10/1
- of pH ≤ pKInd -1
De basische kleur van de indicator kan worden waargenomen als er 10 keer meer basische dan zure deeltjes aanwezig zijn. De basische kleur van de indicator zal dus worden waargenomen bij:
- cH+ < KInd × 1/10
- of pH > pKInd +1
PH = pKInd ± 1 noemen we het theoretisch omslaggebied van een indicator met evenwichtsconstante KInd. Dit theoretisch omslaggebied is dus een gebied van 2 pH-eenheden.Voor sommige indicatoren kan het menselijk oog wel een kleiner omslaggebied waarnemen. In onderstaande tabel wordt een overzicht gegeven.
| Zuur-base-indicator | Kleur als zuur | Kleur als base | Omslaggebied | KInd | pKInd |
|---|---|---|---|---|---|
| Hematoxyline | rood | geel | 0.0 - 1.0 | 1×10-1 | 1.0 |
| Kresolrood | rood | geel | 0.0 - 1.0 | 1×10-1 | 1.0 |
| Kristalviolet | geel | blauw | 0.0 - 1.8 | 1.26×10-1 | 0.9 |
| Thymolblauw | rood | geel | 1.2 - 2.8 | 2.24×10-2 | 1.65 |
| Dimethylgeel | rood | geel | 2.9 - 4.0 | 5.01×10-4 | 3.3 |
| Congorood | violet | oranjerood | 3.0 - 5.0 | 1×10-4 | 4 |
| Methyloranje | oranjerood | geel | 3.2 - 4.4 | 3.98×10-4 | 3.4 |
| Broomkresolgroen | geel | blauw | 3.8 - 5.4 | 1.20×10-5 | 4.7 |
| Methylrood | rozerood | geel | 4.8 - 6.0 | 1.12×10-5 | 4.95 |
| Broomfenolrood | geel | paarsrood | 5.2 - 6.8 | 1×10-6 | 6 |
| Lakmoes | rood | blauw | 5.5 - 8.0 | 1.78×10-7 | 6.75 |
| Broomthymolblauw | geel | blauw | 6.0 - 7.6 | 1.58×10-7 | 6.8 |
| Fenolrood | geel | rood | 6.6 - 8.0 | 1.30×10-8 | 7.9 |
| Neutraalrood | rood | oranjegeel | 6.8 - 8.0 | 4×10-8 | 7.4 |
| Kresolrood | geel | rood | 7.0 - 8.8 | 1.3×10-8 | 7.9 |
| Thymolblauw | geel | blauw | 8.0 - 9.6 | 2×10-9 | 8.8 |
| Fenolftaleïne | kleurloos | paarsrood | 8.2 - 10.0 | 6.31×10-10 | 9.2 |
| Thymolftaleïne | kleurloos | blauw | 9.4 - 10.6 | 1×10-10 | 10 |
| Alzarinegeel-R | lichtgeel | blauwviolet | 10.1 - 12.0 | 6.31×10-12 | 11.2 |
| Indigokarmijn | blauw | geel | 11.5 - 14.0 | 6.31×10-12 | 11.2 |
| 1,3,5-trinitrobenzeen | kleurloos | oranje | 12.0 - 14.0 | 1×10-10 | 10 |
Mengindicatoren
Om het equivalentiepunt bij een zuur-basetitratie vast te stellen, wordt meestal 1 welbepaalde indicator toegevoegd. In kleurloze oplossingen zijn kleuromslagen steeds duidelijk waar te nemen. Indien er echter bepalingen worden gedaan in gekleurde oplossingen, dan is dit niet altijd het geval. Daarom wordt er vaak gebruik gemaakt van mengindicatoren, een mengsel bestaande uit twee of meerdere indicatoren. Een veel gebruikt voorbeeld is een mengsel van methylrood en broomcresolgroen.Voorbeeld: bepaling van natriumboraat (Na3BO3) in een oranje gekleurde oplossing door een titratie met zoutzuur (HCl)
Titratiereactie: Na3BO3 + 3HCl → H3BO3 + 3NaCl
Universeel indicator
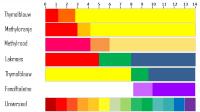 Universeel indicator
Universeel indicator© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Standaardisaties bij zuur-basetitratiesJe kan de concentratie van een zure of een basische oplossing bepalen aan de hand van een zuur-basetitratie. Om de conce…
Standaardisaties bij zuur-basetitratiesJe kan de concentratie van een zure of een basische oplossing bepalen aan de hand van een zuur-basetitratie. Om de conce…
 Hoe stel ik een vergelijking op voor een zuur-basereactie?Een zuur-basereactie is een chemische reactie waarbij, zoals het woord eigenlijk al aanduidt, een zuur met een base reag…
Hoe stel ik een vergelijking op voor een zuur-basereactie?Een zuur-basereactie is een chemische reactie waarbij, zoals het woord eigenlijk al aanduidt, een zuur met een base reag…
 Van zuur naar neutraal naar basischZuur-base reacties kom je eigenlijk overal wel tegen. Ze vinden zelfs in je eigen lichaam plaats. Het maagzuur moet wel…
Van zuur naar neutraal naar basischZuur-base reacties kom je eigenlijk overal wel tegen. Ze vinden zelfs in je eigen lichaam plaats. Het maagzuur moet wel…
 Atoomabsorptie- en atoomemissiespectrofotometrie (AAS/AES)Atoomabsorptiespectrofotometrie (AAS) en atoomemissiespectrofotometrie (AES) zijn zeer specifieke spectrofotometrische m…
Atoomabsorptie- en atoomemissiespectrofotometrie (AAS/AES)Atoomabsorptiespectrofotometrie (AAS) en atoomemissiespectrofotometrie (AES) zijn zeer specifieke spectrofotometrische m…
 De werking van een lampje in een reddingsvestReddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden…
De werking van een lampje in een reddingsvestReddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden…
Gerelateerde artikelen
Heading indicatorDe heading indicator behoord tot de basic six. Met dit instrument wordt er gebruik gemaakt van een gyroscopisch kompas.…
Bronnen en referenties
- Inleidingsfoto: Wuestenigel, Flickr (CC BY-2.0)
- Binas, Wolters, Noordhoff
- Analytische scheikunde 1, W. Biermans, A. Pyra en F. Schuyten
Guust2016 (74 artikelen)
Gepubliceerd: 07-09-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Gepubliceerd: 07-09-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.