De vergelijking van Nernst
 De normpotentiaal van een redoxkoppel geeft aan hoe sterk het oxiderend vermogen en het reducerend vermogen van respectievelijk de oxidator en de reductor van het redoxkoppel is. Een hoge normpotentiaal wijst op een sterke oxidator en een lage normpotentiaal wijst op een sterke reductor. Deze normpotentialen werden gemeten onder normomstandigheden. Om het oxidatie- en reductievermogen in andere omstandigheden te kennen, moet er een omrekening gebeuren aan de hand van de vergelijking van Nernst.
De normpotentiaal van een redoxkoppel geeft aan hoe sterk het oxiderend vermogen en het reducerend vermogen van respectievelijk de oxidator en de reductor van het redoxkoppel is. Een hoge normpotentiaal wijst op een sterke oxidator en een lage normpotentiaal wijst op een sterke reductor. Deze normpotentialen werden gemeten onder normomstandigheden. Om het oxidatie- en reductievermogen in andere omstandigheden te kennen, moet er een omrekening gebeuren aan de hand van de vergelijking van Nernst.
- De vergelijking van Nernst
- Invloed van de concentratie op de potentiaal van een redoxkoppel
- Invloed van de pH op de potentiaal van een redoxkoppel
- Invloed van de concentratie op een volledige redoxreactie
- Invloed van de pH op een volledige redoxreactie
De vergelijking van Nernst
Normpotentialen gelden zoals de naam het zegt, bij normomstandigheden, d.w.z. bij een temperatuur van 25°C (298K), bij een druk van 1 atm en bij een concentratie van 1 mol/L. Om de potentiaal van een redoxkoppel onder andere omstandigheden te kennen, dient de normpotentiaal omgezet te worden aan de hand van de vergelijking van Nernst.Voor redoxkoppel Ox/Red: E = E° + (2.303.R.T)/(n.F) × log(cox/cred)
- R = 8.31J/(K.mol)
- T = heersende temperatuur in K
- n = het aantal uitgewisselde elektronen
- F = de Faraday constante = 9.65.104 C/mol
- cox = de concentratie van de geoxideerde vorm in mol/L
- cred = de concentratie van de gereduceerde vorm in mol/L
Wanneer de constanten in de vergelijking worden vervangen door hun waarden en er een temperatuur van 298K wordt verondersteld, dan kan de vergelijking van Nernst worden vereenvoudigd tot: E = E° + 0.059/n × log(cox/cred)
Voorbeeld 1: Redoxkoppel Fe2+/Fe
Voor dit redoxkoppel kan volgende deelreactie worden geschreven:
Fe2+ + 2e- = Fe
De vergelijking van Nernst kan dus als volgt worden geschreven:
E(Fe2+/Fe) = E°(Fe2+/Fe) + 0.059/2 × log (cFe2+/cFe)
Daar Fe een vaste stof is, kan cFe gelijk gesteld worden aan 1.
E(Fe2+/Fe) = E°(Fe2+/Fe) + 0.059/2 × log cFe2+
Voorbeeld 2: redoxkoppel ClO-/Cl2
Voor dit redoxkoppel kan volgende deelreactie worden geschreven:
2ClO- + 2e- + 4H+ = Cl2 + 2H2O
Voor deze deelreactie dient de vergelijking van Nernst als volgt te worden geschreven:
E(ClO-/Cl2) = E°(ClO-/Cl2) + 0.059/2 * log ((cClO-2 × cH+4)/(cCl2 × cH2O2))
Dus bij deelreacties waarbij naast de oxidator en de reductor ook nog andere ionen en of moleculen betrokken zijn in de deelreactie, dienen de concentraties van deze ionen en of moleculen ook in de vergelijking van Nernst te worden verrekend. Coëfficiënten worden in de vergelijking van Nernst meegenomen als machten.
Cl2 is een gas en hiervoor mag bij atmosferische druk de concentratie gelijkgesteld worden aan 1. Ook cH2O mag steeds worden geschreven als 1.
Dus vereenvoudigd geeft dit voor het ClO-/Cl2-koppel:
E(ClO-/Cl2) = E°(ClO-/Cl2) + 0.059/2 × log (cClO-2 × cH+4)
Invloed van de concentratie op de potentiaal van een redoxkoppel
We nemen als voorbeeld het cerium-koppel Ce4+/Ce3+ met als deelreactie: Ce4+ + e- = Ce3+De vergelijking van Nernst wordt voor deze deelreactie: E(Ce4+/Ce3+) = E°(Ce4+/Ce3+) + 0.059 × log (cCe4+/cCe3+)
- Indien de concentratie van Ce4+ stijgt, zal de potentiaal van het koppel toenemen. Een hogere potentiaal wijst op een groter oxiderend vermogen. Indien de concentratie van Ce4+ stijgt, zal dus ook zijn oxiderend vermogen stijgen.
- Indien de concentratie van Ce3+ stijgt, zal de potentiaal van het koppel afnemen. Een lagere potentiaal wijst op een groter reducerend vermogen. Indien de concentratie van Ce3+ stijgt, zal dus ook zijn reducerend vermogen stijgen.
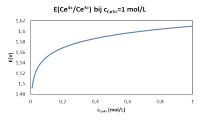 Invloed van cCe4+ op E(Ce4+/Ce3+)
Invloed van cCe4+ op E(Ce4+/Ce3+)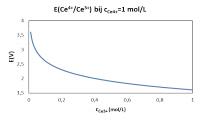 Invloed van cCe3+ op E(Ce4+/Ce3+)
Invloed van cCe3+ op E(Ce4+/Ce3+)Invloed van de pH op de potentiaal van een redoxkoppel
De pH van een oplossing geeft aan hoe zuur of hoe basisch een oplossing is.- Hoe meer H+-ionen een oplossing bevat, hoe zuurder deze oplossing is en hoe lager de pH van deze oplossing is:
- pH = -log cH+
- Hoe meer OH-ionen een oplossing bevat, hoe basischer deze oplossing is en hoe hoger de pH van de oplossing is:
- pH = 14 + log cOH-
In de deelreactie van bijvoorbeeld het redoxkoppel Fe2+/Fe komen geen H+ of OH--ionen voor. Schommelingen in de pH zullen dus geen invloed hebben op het oxiderend en het reducerend vermogen van respectievelijk Fe2+ en Fe. E(Fe2+/Fe) is dus onafhankelijk van de pH.
Het redoxvermogen van redoxkoppels waarvoor er wel H+- of OH--ionen in de deelreactie voorkomen, is wel afhankelijk van de pH. Een voorbeeld hiervan is het redoxkoppel ClO-/Cl2
- Deelreactie: 2ClO- + 2e- + 4H+ = Cl2 + 2H2O
- Vergelijking van Nernst: E(ClO-/Cl2) = E°(ClO-/Cl2) + 0.059/2 × log cClO-2 × cH+4
Hoe meer H+-ionen er in de ClO--oplossing zitten en hoe zuurder de oplossing dus is, hoe hoger de potentiaal van het koppel wordt. Het oxiderend vermogen van de ClO--ionen neemt dus toe bij verlaging van de pH. E(ClO-/Cl2) neemt dus af met een stijgende pH.
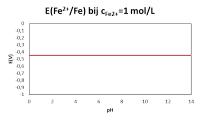 Invloed van de pH op E(Fe2+/Fe)
Invloed van de pH op E(Fe2+/Fe)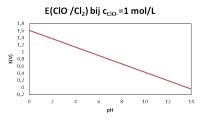 Invloed van de pH op E(ClO-/Cl2)
Invloed van de pH op E(ClO-/Cl2)Invloed van de concentratie op een volledige redoxreactie
We nemen als voorbeeld de combinatie van de redoxkoppels K+/K en Ba2+/Ba.- E°(K+/K) = -2.931 V
- E°(Ba2+/Ba)= -2.912 V
Op basis van de normpotentialen van beide koppels kan geconcludeerd worden dat bij normomstandigheden kalium (K) een sterkere reductor is dan barium (Ba) en dat Ba2+ een sterkere oxidator is dan K+. Door het kleine verschil in normpotentiaal is het echter mogelijk om de rollen om te draaien. Zoals weergegeven in onderstaande grafiek kan er met een juiste concentratie aan K+- en Ba2+-ionen voor worden gezorgd dat K+ een sterkere oxidator wordt dan Ba2+.
In de grafiek wordt voor beide koppels de evolutie van de redoxpotentiaal weergegeven in functie van de ionenconcentratie.
- De blauwe curve stelt de evolutie van E(K+/K) weer voor een concentratie 0 < cK+ ≤ 1mol/L
- De rode curve stelt de evolutie van E(Ba2+/Ba) weer voor een concentratie 0 < cBa2+ ≤ 1mol/L
De grijze zones stellen de omstandigheden voor waarbij K steeds de sterkste reductor en Ba2+ steeds de sterkste oxidator is.
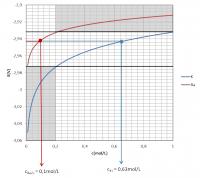
- Voor 0 mol/L < cK+ < 0.2 mol/L : E(K+/K) is in alle omstandigheden kleiner is dan E(Ba2+/Ba)
- Voor 0.2 mol/L < cBa2+ < 1 mol/L : E(Ba2+/Ba) is in alle omstandigheden groter dan E(K+/K)
- Bij cK+ > 0.2 mol/L en bij cBa2+ < 0.2 mol/L kunnen de rollen wel worden omgedraaid.
Stel bijvoorbeeld cBa2+ = 0.1 mol/L. Indien cK+ groter is dan 0.63 mol/L, zal de potentiaal van het kaliumkoppel groter zijn dan dat van het bariumkoppel en zal Ba dus een sterkere reductor zijn.
Invloed van de pH op een volledige redoxreactie
We nemen als voorbeeld de combinatie van de redoxkoppels MnO4-/Mn2+ en Cl2/Cl-- E°(MnO4-/Mn2+) = 1.507V
- E°(Cl2/Cl-) = 1.358V
Deelreacties:
- MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
- Cl2 + 2e- = 2Cl-
Op basis van de deelreacties weten we dat het oxiderend vermogen en het reducerend vermogen van respectievelijk Cl2 en Cl- onafhankelijk is van de pH. Voor het oxiderend en reducerend vermogen van respectievelijk MnO4 - en Mn2+ is dit wel het geval.
Onderstaande grafiek werd opgesteld door de redoxpotentiaal van beide redoxkoppels te berekenen voor een pH van 0 tot 14 en dus voor cH+ van 1 tot 10-14 mol/L. De concentraties van alle andere betrokken stoffen en ionen werden hierbij gelijk gesteld aan 1 mol/L.
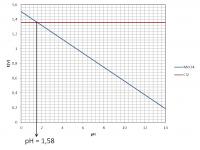
- Voor het redoxkoppel Cl2/Cl- krijgen we door de onafhankelijkheid van de pH een horizontale rechte. Omdat de concentratie aan Cl--ionen gelijk werd gesteld aan 1 mol/L, is voor dit redoxkoppel de redoxpotentiaal bij elke pH-waarde gelijk aan de normpotentiaal.
- Voor de het redoxkoppel MnO4-/Mn2+ wordt een dalende rechte verkregen. Een stijgende pH, en dus een daling in cH+, resulteert immers in een daling van de redoxpotentiaal van dit koppel.
Op basis van de normpotentialen van beide koppels weten we dat bij normomstandigheden MnO4- een sterkere oxidator is dan Cl2. Onder normomstandigheden is cH+ = 1 mol/L wat overeenkomt met een pH van 0. De curve van het MnO4-/Mn2+-koppel ligt bij lage pH dan ook boven de curve van het Cl2/Cl--koppel. Bij een pH vanaf 1.58 draaien de rollen echter om. Bij een pH > 1.58 is het oxiderend vermogen van Cl2 groter dan dat van MnO4- en het reducerend vermogen van Mn2+ groter dan dat van Cl-.
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Bleekwater en zure ontkalker, een gevaarlijke chloorcocktailBleekwater (of javel) bevat hypochlorietionen (ClO-) die als sterke oxidator fungeren t.o.v. kleurstoffen (bleekwater) e…
Bleekwater en zure ontkalker, een gevaarlijke chloorcocktailBleekwater (of javel) bevat hypochlorietionen (ClO-) die als sterke oxidator fungeren t.o.v. kleurstoffen (bleekwater) e…
 Bepaling van normpotentialenElke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is e…
Bepaling van normpotentialenElke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is e…
 Invloed van de pH op zuurstof- en zuurcorrosieCorrosie is de ongewenste oxidatie van een metaal en wordt vooral veroorzaakt door zuurstof (zuurstofcorrosie) en water…
Invloed van de pH op zuurstof- en zuurcorrosieCorrosie is de ongewenste oxidatie van een metaal en wordt vooral veroorzaakt door zuurstof (zuurstofcorrosie) en water…
 Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
 De sterkte van oxidatoren en reductorenRedoxreacties zijn reacties waarbij er elektronen worden uitgewisseld tussen een oxidator en een reductor. Niet alle oxi…
De sterkte van oxidatoren en reductorenRedoxreacties zijn reacties waarbij er elektronen worden uitgewisseld tussen een oxidator en een reductor. Niet alle oxi…
 Kwantumgetallen: van schil tot orbitaalEen atoom bestaat uit neutronen, protonen en elektronen. De neutronen en de protonen van een atoom vormen de kern van ee…
Kwantumgetallen: van schil tot orbitaalEen atoom bestaat uit neutronen, protonen en elektronen. De neutronen en de protonen van een atoom vormen de kern van ee…
Gerelateerde artikelen
Bronnen en referenties
- Analytical chemistry, Skoog, West en Holler
- Binas, Wolters, Noordhoff
Guust2016 (74 artikelen)
Gepubliceerd: 05-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Gepubliceerd: 05-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.