De beknopte weergave van een galvanische cel
 De samenstelling van een galvanische cel kan op 1 lijn worden weergegeven. De scheiding tussen de twee halfcellen wordt hierbij voorgesteld door twee schuine strepen. Aan de linkerzijde wordt de anodische halfcel uitgeschreven, dit is de halfcel waar de oxidatie optreedt. Aan de rechterzijde wordt de katodische halfcel, de cel waar de reductie optreedt, genoteerd. Een enkele schuine streep wordt in de notatie gebruikt om de scheiding aan te geven tussen componenten in een verschillende aggregatietoestand. Componenten in dezelfde aggregatietoestand worden in de weergave gescheiden door een komma. Voor ionen in oplossing worden de concentraties tussen haakjes vermeld.
De samenstelling van een galvanische cel kan op 1 lijn worden weergegeven. De scheiding tussen de twee halfcellen wordt hierbij voorgesteld door twee schuine strepen. Aan de linkerzijde wordt de anodische halfcel uitgeschreven, dit is de halfcel waar de oxidatie optreedt. Aan de rechterzijde wordt de katodische halfcel, de cel waar de reductie optreedt, genoteerd. Een enkele schuine streep wordt in de notatie gebruikt om de scheiding aan te geven tussen componenten in een verschillende aggregatietoestand. Componenten in dezelfde aggregatietoestand worden in de weergave gescheiden door een komma. Voor ionen in oplossing worden de concentraties tussen haakjes vermeld.
- Galvanische cel
- Uitgewerkte voorbeelden
- 1: Zn2+(1 mol/L) / Zn en Cu2+(1 mol/L) / Cu
- 2: H+(0.01 mol/L) / H2 (1 atm) en Cl2(1 atm) / Cl-(0.2 mol/L)
- 3: Fe3+(0.02 mol/L) / Fe2+(0.03 mol/L) en Ce4+(0.25 mol/L) / Ce3+(0.1 mol/L)
Galvanische cel
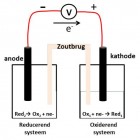
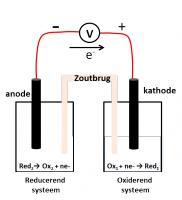
Een galvanische cel is een elektriciteit leverend systeem waarbij twee redoxkoppels van elkaar worden gescheiden in twee aparte compartimenten en met elkaar worden verbonden door een geleidende draad en een zoutbrug. Beide compartimenten worden de halfcellen van de galvanische cel genoemd. Het redoxkoppel met de sterkste oxidator zal elektronen aantrekken en het koppel met de sterkste reductor zal elektronen afgeven. Er zullen dus spontaan elektronen vloeien van het component met de sterkste reductor naar het compartiment met de sterkste oxidator.Stel twee redoxkoppels Ox1/Red1 en Ox2/Red2. Beide koppels worden gekenmerkt door een bepaalde normpotentiaal. Deze normpotentialen geven informatie over de relatieve oxidatorsterkte van ox1 en ox2 en over de relatieve reductorsterkte van red1 en red2. Indien E°(ox1,red1) > E°(ox2,red2), zal het eerste redoxkoppel de oxidator leveren en het tweede koppel de reductor.
- Ox1 + ne- → Red1
- Red2 → Ox2 + ne-
Het eerste redoxkoppel vormt het oxiderend en het tweede koppel het reducerend systeem. Wanneer een galvanische cel volgens de beknopte weergave wordt voorgesteld, is het niet nodig om de normpotentialen van de betrokken koppels op te zoeken. Op basis van de weergave kan worden afgeleid welk koppel de oxidator en welk koppel de reductor levert. Het reducerend systeem wordt links en het oxiderend systeem wordt rechts genoteerd. Beiden worden van elkaar gescheiden door twee schuine strepen.
Reducerend systeem // oxiderend systeem
Uitgewerkte voorbeelden
1: Zn2+(1 mol/L) / Zn en Cu2+(1 mol/L) / Cu
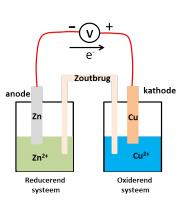
- E°(Zn2+/Zn) = -0.763V → reducerend systeem
- E°(Cu2+/Cu) = 0.345V → oxiderend systeem
In de beknopte weergave zal het zink (Zn)-koppel dus links worden geschreven. Van elk koppel zal de gereduceerde vorm (Cu en Zn) aan de buitenkant worden geschreven en de geoxideerde vorm (Cu2+ en Zn2+) aan de binnenkant. Cu2+ en Zn2+ zijn ionen in oplossingen en Cu en Zn zijn vaste stoffen. Omdat de aggregatietoestand van de geoxideerde en de gereduceerde vorm voor beide koppels verschillend is, worden deze in de beknopte weergave van elkaar gescheiden door een schuine streep. De concentratie van de ionen wordt na het ion tussen haakjes weergegeven.
Zn / Zn2+(1 mol/L) // Cu2+(1 mol/L) / Cu
2: H+(0.01 mol/L) / H2 (1 atm) en Cl2(1 atm) / Cl-(0.2 mol/L)
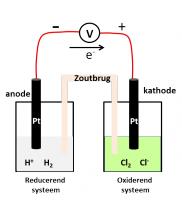
- E°(H+ / H2) = 0.000 V → reducerend systeem
- E°(Cl2 / Cl-) = 1.358 V → oxiderend systeem
In de beknopte weergave zal het waterstof (H)-koppel links en het chloor (Cl)-koppel rechts worden geschreven. De geoxideerde vormen H+ en Cl2 worden in het midden geschreven. Omdat Cl2 een gas is, zal hiervan de dampdruk tussen haakjes worden vermeld. De gereduceerde vormen H2 en Cl- worden aan de buitenkant geschreven. Beide redoxkoppels zijn samengesteld uit een ion in oplossing en een gas welke zullen worden gescheiden door een schuine streep. Omdat er geen vaste stoffen betrokken zijn, dient elk compartiment een inerte elektrode te bevatten. Pt elektroden kunnen hiervoor worden gebruikt. Deze dienen ook in de beknopte weergave voor te komen en worden aan weerszijden aan de buitenkant geschreven.
Pt / H2(1 atm) / H+(0.01 mol/L) // Cl2(1 atm) / Cl-(0.2 mol/L) / Pt
3: Fe3+(0.02 mol/L) / Fe2+(0.03 mol/L) en Ce4+(0.25 mol/L) / Ce3+(0.1 mol/L)
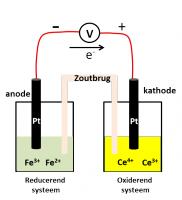
- E°(Fe3+/Fe2+) = 0.771V → reducerend systeem
- E°(Ce4+ / Ce3+) = 1.610V → oxiderend systeem
In de beknopte weergave zal het ijzer (Fe)-koppel aan de linkerkant en het cerium (Ce)-koppel aan de rechterkant staan. Van beide koppels zullen de geoxideerde vormen in het midden staan en de gereduceerde vormen aan de buitenkant. Omdat voor beide koppels alle stoffen in oplossing voorkomen en zich dus in dezelfde aggregatietoestanden bevinden, zullen de geoxideerde en de gereduceerde vormen hier van elkaar worden gescheiden door een komma. Ook hier zijn interte platina-elektroden nodig om de galvanische cel te vervolledigen.
Pt / Fe2+(0.03 mol/L) , Fe3+0.02 mol/L) // Ce4+(0.25 mol/L) , Ce3+(0.1 mol/L) / Pt
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Bepaling van normpotentialenElke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is e…
Bepaling van normpotentialenElke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is e…
 Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
Natrium en dichloor uit keukenzout, theoretisch bekekenWanneer je ooit de reactie tussen natriummetaal en water hebt gezien, weet je dat die vrij explosief is. De elektrolytis…
 De werking van een lampje in een reddingsvestReddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden…
De werking van een lampje in een reddingsvestReddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden…
 Bleekwater en zure ontkalker, een gevaarlijke chloorcocktailBleekwater (of javel) bevat hypochlorietionen (ClO-) die als sterke oxidator fungeren t.o.v. kleurstoffen (bleekwater) e…
Bleekwater en zure ontkalker, een gevaarlijke chloorcocktailBleekwater (of javel) bevat hypochlorietionen (ClO-) die als sterke oxidator fungeren t.o.v. kleurstoffen (bleekwater) e…
 Bereiding en standaardisatie van een dijood-oplossingEen dijood-oplossing kan worden gebruikt als indicator om zetmeel aan te tonen. In aanwezigheid van zetmeel krijgt dijoo…
Bereiding en standaardisatie van een dijood-oplossingEen dijood-oplossing kan worden gebruikt als indicator om zetmeel aan te tonen. In aanwezigheid van zetmeel krijgt dijoo…
 Permanganometrie: redoxtitraties met kaliumpermanganaatPermanganometrie is een verzamelnaam voor redoxtitraties waarbij als titrant kaliumpermanganaat wordt gebruikt. In water…
Permanganometrie: redoxtitraties met kaliumpermanganaatPermanganometrie is een verzamelnaam voor redoxtitraties waarbij als titrant kaliumpermanganaat wordt gebruikt. In water…
Gerelateerde artikelen
Bronnen en referenties
- Analytical chemistry, Skoog, West en Holler
- Binas, Wolters, Noordhoff
Guust2016 (74 artikelen)
Gepubliceerd: 27-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Gepubliceerd: 27-11-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.