Wolfraam: Het element
 Wolfraam is een bijzonder metaal. Het technisch zuivere metaal is zacht en kan geknipt en vervormd worden met eenvoudige plaatwerkgereedschap maar reeds weinig legeringselementen geven het een grote sterkte en hardheid. Het heeft het hoogste smeltpunt van alle metalen en wolfraamlegeringen worden toegepast van het kogeltje in de balpoint tot pantserstaal. Meeste wolfraam(carbide) wordt gebruikt voor de bereiding van gereedschapstaal met name van Hardmetaal, een zeer slijtvast metaal dat gebruikt wordt voor de vervaardiging van snijgereedschap als draaibeitels en frezen.
Wolfraam is een bijzonder metaal. Het technisch zuivere metaal is zacht en kan geknipt en vervormd worden met eenvoudige plaatwerkgereedschap maar reeds weinig legeringselementen geven het een grote sterkte en hardheid. Het heeft het hoogste smeltpunt van alle metalen en wolfraamlegeringen worden toegepast van het kogeltje in de balpoint tot pantserstaal. Meeste wolfraam(carbide) wordt gebruikt voor de bereiding van gereedschapstaal met name van Hardmetaal, een zeer slijtvast metaal dat gebruikt wordt voor de vervaardiging van snijgereedschap als draaibeitels en frezen.
Inhoud
- Wolfraam-ertsen
- Wolfraam bereiding
- Toepassingen van wolfraam
- Laselektrode
- Milieu en gezondheid
- Chemische en fysische eigenschappen
 Wolfraamerts Huebneriet / Bron: Eurico Zimbres & Tom Epaminondas, Wikimedia Commons (CC BY-SA-2.5)
Wolfraamerts Huebneriet / Bron: Eurico Zimbres & Tom Epaminondas, Wikimedia Commons (CC BY-SA-2.5)Wolfraam-ertsen
Meest voorkomende wolfraam ertsen zijn wolframiet, scheeliet, ferberiet en huebneriet. Het wordt aangetroffen in in China (75% van de wereldproductie), Bolivia, Verenigde Staten, Oostenrijk, Portugal, Rusland en Zuid-Korea. Heden wordt meeste wolfraam gewonnen uit wolframiet((Fe, Mn)WO4) en scheeliet (CaWO4).Wolfraam bereiding
Wolfraam ertsen worden gesmolten met natriumhydroxide, waarbij natriumwolframaat ontstaat, dat wordt omgezet in ammoniumwolframaat, waaruit door verhitten wolfraamtrioxide (WO3) ontstaat, dat met waterstof of koolstof wordt gereduceerd tot poedervormig metaal en koolstofdioxide (CO2). Door persen in een waterstof atmosfeer en walsen wordt metaal in draad- of plaatvorm vervaardigd. De wereld jaarproductie is ongeveer 70.000 ton.Wolfraam een zacht lichtgrijs-wit metaal dat is te knippen met een tang en taai zodat het tot draad getrokken kan worden en in mallen geperst. Echter verbindingen als wolfraamcarbiden zijn zeer hard en creëren sterke slijtvaste wolfraamlegeringen.
 Wolfraamerts Wolframiet / Bron: Eurico Zimbres & Tom Epaminondas, Wikimedia Commons (CC BY-SA-2.0)
Wolfraamerts Wolframiet / Bron: Eurico Zimbres & Tom Epaminondas, Wikimedia Commons (CC BY-SA-2.0) Wolfraamerts Scheeliet / Bron: Didier Descouens, Wikimedia Commons (CC BY-SA-4.0)
Wolfraamerts Scheeliet / Bron: Didier Descouens, Wikimedia Commons (CC BY-SA-4.0) Wolfraamerts Ferberiet / Bron: Didier Descouens, Wikimedia Commons (CC BY-SA-4.0)
Wolfraamerts Ferberiet / Bron: Didier Descouens, Wikimedia Commons (CC BY-SA-4.0)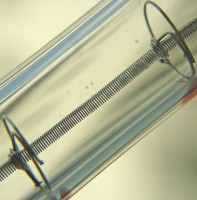 Wolfram spiraaldraad in een gloeilamp / Bron: Planemad, Wikimedia Commons (CC BY-SA-2.5)
Wolfram spiraaldraad in een gloeilamp / Bron: Planemad, Wikimedia Commons (CC BY-SA-2.5)Toepassingen van wolfraam
- Elektrische contacten en schakelingen; contactpunten in motoren.
- Wolfraam metaal met hoogste smeltpunt, is prima geschikt als gloeidraad in gloeilampen, straalkachels, buizen voor sterke radiozenders en voor televisies.
- Hitteschild bij ruimtevaartuigen en de neuzen van luchtdoelraketten.
- Kernreactortechnologie, o.a. containers voor splijtstof voor kernreactoren.
- Matrijzen en walsen.
- Hittevaste stalen met grote treksterkte bij hoge temperaturen. Wolfraamstaal (W,Fe; plus Ni,Cu en Cr) beschermt bij hoge temperaturen tegen oxidatie. Bij temperaturen tot circa 2000°C blijft het hardheid behouden, waardoor het gebruikt wordt als pantserstaal en omhulsel van granaten en kogels. Legeringen van wolfraam met zirkonium, niobium en tantaal worden gebruikt in uitlaatpijpen van raketten en straalmotoren.
- Allerlei soorten ovens.
- Röntgentechnologie en randapparatuur.
- Slijpwerktuigen (W,Ni,Fe).
- Als katalysator in de olie-industrie; nikkelwolfraamsulfide verwijdert zwavel en stikstof uit aardoliefracties.
- Doordat wolfraam dezelfde uitzettingscoefficient heeft als glas kan het in glas worden gegoten.
- Wolfraamcarbide (WC en W2C) met kobalt als bindmiddel, is bekend als hardmetaal, een zeer hard materiaal dat gebruikt wordt in boor- en snijgereedschap, zoals frezen voor hout en metaalbewerking en tandartsboren.
- Wolfraam en legeringen zoals: WNiFe, WNiMoFe of WNiCu), worden toegepast (i.p.v. lood) bij de afscherming van radioactieve straling.
- Vanwege de hoge dichtheid wordt het toegepast als balansgewicht in vliegwielen van motoren en voor uitbalanceren van propellers en scheepsroeren
Toepassingen van wolfraam verbindingen
- Bekleden van materialen om ze slijtvast en hittebestendig te maken (WC)
- Elektrodemateriaal (Li2WO2)
- Elektrodemateriaal in brandstofcellen (WC)
- Halogeenlampen (WI6)
- Katalysator in de petrochemie (WS2) (WO3), (W18O49), (W20O58)
- Ontzwaveling in de petrochemie ammoniummetawolframaat
- Pigmenten (wolframaten)
- Smeer- en slijpmiddel voor boorinstallaties. Wolfraam disulfide (WS2) is een droge smeerolie, gebruikt bij temperaturen tot 500°C.
- Bepaalde wolfraam verbindingen met magnesium en calcium hebben fosforescerende eigenschappen. Röntgenfluorescentiestof (wolfraamzuur)
Laselektrode
Als bij deze vorm van lassen een wolfraamelektrode wordt gebruikt, spreken we van TIG-lassen (Tungsten-Inert-Gas); als het te lassen metaal zelf als elektrode dient, spreekt men van MIG-lassen (Metal-Inert-Gas).Milieu en gezondheid
- Wolfraam is een veilig metaal. Bijzondere voorzorg- en veiligheidsmaatregelen zijn niet nodig. Er is geen schade bekend die veroorzaakt is door wolfraam.
- Blootstelling aan wolfraam is niet gevaarlijk. Industriële ervaring toont aan dat wolfraam geen ziektes veroorzaakt bij werklieden in staalfabrieken en blootstelling aan de oplossingsproducten van wolfraam(bij 5 mg/m3 lucht).
- Niet chronische maar tijdelijk is het irriteren van huid en ogen. Inademing veroorzaakt irritatie van longen en slijmvliezen. Oogirritatie veroorzaakt tranen en roodheid. Huidcontact veroorzaakt roodheid, jeuk en schilfering, als men geen beschermende kleding draagt.
- Meeste wolfraamverbindingen zijn toxisch.
- Het stof van wolfraam in metaalvorm is licht ontvlambaar en explosief.
Chemische en fysische eigenschappen
| Naam | wolfraam, wolframium, tungsten |
|---|---|
| Symbool | W |
| Atoomnummer | 74 |
| Atoommassa | 183,84 |
| Oxidatietoestanden | +6 |
| Groep | Chroomgroep: Chroom, Molybdeen, Wolfraam, Seaborgium |
| Periode | periode 6 |
| Blok | D blok |
| Reeks | overgangsmetalen |
| Kleur | grijswit |
| Atoomstraal | 139 pm: pm= picometer = 10 -12 meter. |
| Elektronegativiteit (eV) Pauling | 2.36 |
| Kristalstructuur (atoomrooster 20grC) | KRG |
| Rooster Constante bij 20 º C, Angstrom | 3,1585 |
| Dichtheid | 19,3 g/cm3 |
| Hardheid Mohs | 7,5 |
| Smeltpunt | 3422 grC |
| Kookpunt | 5555 grC |
| Aggregatietoestand | vast |
| Smeltwarmte KJ/mol | 35,4 |
| Verdampingswarmte KJ/mol | 824,0 |
| Specifieke warmte J/kg/K | 130 |
| Elektrische weerstand 20 º C Elektrische weerstand 227 º C Elektrische weerstand 727 º C Elektrische weerstand 1727 º C Elektrische weerstand 2727 º C Elektrische weerstand 3227 º C | 5,5 (microhm-cm) 10,5 24,3 55,7 90,4 108,5 |
| Warmtegeleiding W/m.K | 170 |
| Natuurlijke Isotopen | 5 stabiele180, 182, 183, 184, 186 en 25 instabiele isotopen |
| liniaire uitzettingscoefficient per grC | 4.3 x 10↑-6 |
| Thermische geleidbaarheid bij 20 º C (cal / cm / º C / sec) | 0,40 |
| Specifieke warmte bij 20 º C (cal / g / º C) | 0.032 |
| Elektrische geleidbaarheid,% IACS | 31 |
| Treksterkte (20 grC), N/mm2 | 700 - 3400 |
| Treksterkte 500 º C, N/mm2 | 500 - 1400 |
| reksterkte bij 1000 º C, N/mm2 | 350 - 500 |
| Poisson Ratio | 0,284 |
| Hardheid (Mineral) mohs | 7,5 |
| Hardheid (Vickers) | 3430 |
| Hardheid (Brinell) | 2570 |
| Werk Temperatuur, º C | max. 1700 |
| Rekristallisatie Temperatuur, º C | 1300 - 1500 |
© 2013 - 2025 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Gloeilamp: werking en geschiedenisEen gloeilamp bestaat uit een glazen bol (veelal gevuld met stikstof of een edelgas) met daarin een gloeidraad. Door de…
Gloeilamp: werking en geschiedenisEen gloeilamp bestaat uit een glazen bol (veelal gevuld met stikstof of een edelgas) met daarin een gloeidraad. Door de…
 De uitvinding van de gloeilampIs de gloeilamp uitgevonden door één enkele persoon? Er zijn goede redenen om Edison aan te wijzen als uitvinder, maar i…
De uitvinding van de gloeilampIs de gloeilamp uitgevonden door één enkele persoon? Er zijn goede redenen om Edison aan te wijzen als uitvinder, maar i…
 Tantalium: Het elementTantaal is een hoogwaardige hittebestendig metaal met een lage thermische uitzetting, hoge thermische geleidbaarheid, go…
Tantalium: Het elementTantaal is een hoogwaardige hittebestendig metaal met een lage thermische uitzetting, hoge thermische geleidbaarheid, go…
 Vanadium: Het elementVanadium een kneedbaar grijs-wit metaal die als legeringselement wordt toegevoegd aan staal om hoogwaardige legeringen t…
Vanadium: Het elementVanadium een kneedbaar grijs-wit metaal die als legeringselement wordt toegevoegd aan staal om hoogwaardige legeringen t…
 Chroom: Het elementChroom is een heldere blauw-witte, hard en corrosiebestendig metaal. Het chroomoxide geeft voorwerpen een groenachtige t…
Chroom: Het elementChroom is een heldere blauw-witte, hard en corrosiebestendig metaal. Het chroomoxide geeft voorwerpen een groenachtige t…
Gerelateerde artikelen
Wat is een stroomkring en hoe werkt dat?Je weet dat veel apparaten op elektriciteit werken. Elektriciteit uit een stopcontact of uit een batterij. Maar hoe werk…
Bronnen en referenties
- Bronnen:
- http://home.scarlet.be/weerstation.ransberg/PSE/elem_nlfd1d.html?IDE=W
- http://minerals.usgs.gov/minerals/pubs/commodity/tungsten/
- http://www.bearing-needle.com/15NL-harde-metalen-WC-Co-wolfraam-heavy-legering-WC.htm
- http://www.lenntech.nl/periodiek/elementen/w.htm#ixzz2UigYMIw0
- YDTech® Fabrikant van hard metaal wolfraamcarbide en kobalt, W-Ni-Fe, W-Ni-Cu, Leverancier van harde zware metalen wolfraam legering (WC-TiC-Co) en hardmetaal WC in China.
- http://sciencenotes.org/?attachment_id=320(wolfraam embleem)
- Afbeelding bron 1: Eurico Zimbres & Tom Epaminondas, Wikimedia Commons (CC BY-SA-2.5)
- Afbeelding bron 2: Eurico Zimbres & Tom Epaminondas, Wikimedia Commons (CC BY-SA-2.0)
- Afbeelding bron 3: Didier Descouens, Wikimedia Commons (CC BY-SA-4.0)
- Afbeelding bron 4: Didier Descouens, Wikimedia Commons (CC BY-SA-4.0)
- Afbeelding bron 5: Planemad, Wikimedia Commons (CC BY-SA-2.5)
Custor (173 artikelen)
Laatste update: 30-11-2016
Rubriek: Wetenschap
Subrubriek: Techniek
Bronnen en referenties: 12
Laatste update: 30-11-2016
Rubriek: Wetenschap
Subrubriek: Techniek
Bronnen en referenties: 12
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.