Koolstof: Het element
 Koolstof (Latijn: carbo "steenkool") is een scheikundig element met symbool C en atoomnummer 6. Het is lid van groep 14 van het periodiek systeem. Het is een niet-metaal en heeft vier (valencie)elektronen beschikbaar om covalente chemische bindingen te vormen. Er zijn drie natuurlijke isotopen, 12C en 13C zijn stabiel, en 14C radioactief met een halveringstijd van ongeveer 5730 jaar. Er zijn verscheidene allotropen (structuren)van koolstof waarvan de bekendste zijn grafiet, diamant en amorfe koolstof. De fysische eigenschappen van koolstof sterk variëren met de allotropische vorm. Bijvoorbeeld diamant is zeer transparant, terwijl grafiet ondoorzichtig en zwart is. Diamant is het hardste natuurlijk voorkomende materiaal, terwijl grafiet zacht genoeg is om een streep op papier te zetten.
Koolstof (Latijn: carbo "steenkool") is een scheikundig element met symbool C en atoomnummer 6. Het is lid van groep 14 van het periodiek systeem. Het is een niet-metaal en heeft vier (valencie)elektronen beschikbaar om covalente chemische bindingen te vormen. Er zijn drie natuurlijke isotopen, 12C en 13C zijn stabiel, en 14C radioactief met een halveringstijd van ongeveer 5730 jaar. Er zijn verscheidene allotropen (structuren)van koolstof waarvan de bekendste zijn grafiet, diamant en amorfe koolstof. De fysische eigenschappen van koolstof sterk variëren met de allotropische vorm. Bijvoorbeeld diamant is zeer transparant, terwijl grafiet ondoorzichtig en zwart is. Diamant is het hardste natuurlijk voorkomende materiaal, terwijl grafiet zacht genoeg is om een streep op papier te zetten. Periodiek systeem koolstof atoomnummer 6 / Bron: Cepheus, Wikimedia Commons (Publiek domein)
Periodiek systeem koolstof atoomnummer 6 / Bron: Cepheus, Wikimedia Commons (Publiek domein)Plaats van het element koolstof in het periodieksysteem
Diamant heeft een grote elektrische weerstand, terwijl grafiet een zeer goede elektrische geleider is. Onder normale omstandigheden hebben diamant, koolstof en grafeen de hoogste thermische geleidbaarheid van alle materialen. Van alle koolstof allotropen is grafiet de meest stabiele vorm. De stof is chemisch resistent en temperatuurbestendig. Koolstof vormt een groot aantal verbindingen, meer dan enig ander element. De meest voorkomende oxidatietoestand van koolstof in anorganische verbindingen is 4; toestand 2 wordt gevonden in koolmonoxide en carbonyl complexen. De bronnen van anorganische koolstofverbindingen zijn kalksteen, dolomiet en kooldioxide, de grootste hoeveelheden komen echter voor in organische afzettingen van steenkool, turf, olie en methaanhydraten. Koolstof is de 15e meest voorkomende element in de aardkorst en de vierde meest voorkomende element in het universum na waterstof, helium en zuurstof. In het menselijk lichaam is koolstof de tweede meest voorkomende element (circa 20%) na zuurstof, het is de chemische basis van alle levensvormen.Algemene eigenschappen van het element koolstof
| Naam | Sym bool | Atoom nummer | Groep | Periode | P-Blok | Reeks | Struc- tuur | Allo tropen | Kleuren |
|---|---|---|---|---|---|---|---|---|---|
| Koolstof | C | 6 | 14 koolstof- groep | Periode 2 | Blok-P | Metalloid | Grafiet: hexagonaal Diamant: kubisch | Diamant, Grafiet | Diamant: helder Grafiet: zwart |
Chemische eigenschappen van het element koolstof
| Atoommassa standaard | Oxidatie toestanden | Elektro negativiteit | Atoom straal | ionisatie- potentiaal kJ/mol | Elektron configuratie |
|---|---|---|---|---|---|
| 12.011 | -4, +2. +4 | Pauling scale: 2.55 | Covalente radius: sp3: 77 pm sp2: 73 pm sp: 69 pm Van der Waals radius: 170 pm | 1e: 1086.5 2e: 2352.6 3e: 4620.5 | [He] 2s2 2p2 per schaal: 2, 4 |
Fysische eigenschappen van het element koolstof
| Dicht- heid- g/cm3 | Hard-heid- Mohs | Sublimatie punt | Thermal expansion | Specifieke- warmte- J/kg°K | Electrische- weerstand- microhm.cm | Warmte- geleiding W/m°K |
|---|---|---|---|---|---|---|
| Amorf: 1.8–2.1 Diamant: 3.52 Grafiet: 2.27 | Diamant: 10 grafiet: 1–2 | 3915 K 3642 °C 6588 °F | Diamond: 0.8 µm/m.K (25 °C) | Grafiet:117 | Grafiet: 7.837 | Diamond: 900–2300 Grafiet: 119–165 |
Mechanische eigenschappen van het element koolstof
| Elasticiteitsmodules GPa | Glijmodules GPa | Bulkmodules GPa | Poisson ratio | Magnetisme | gedefinieerd als element |
|---|---|---|---|---|---|
| Diamant 1050 | Diamant 478 | Diamant 442 | Diamant 0,1 | Diamagnetisme | Antoine Lavoisier (1789) |
De koolstof 14 datering
Isotopen van koolstof hebben atoomkernen met zes protonen plus een variabel aantal neutronen. Koolstof heeft twee stabiele in de natuur voorkomende isotopen. De isotoop koolstof-12 (12C) vormt 98,93% van al het koolstof op aarde, koolstof-13 vormt de resterende 1,07%.Koolstof-14 (14C) is een natuurlijk sporadisch voorkomend radioactief isotoop die vervalt door β- emissie. De halveringstijd is 5730 jaar.Koolstof-14 wordt gevormd in de bovenste lagen van de troposfeer en de stratosfeer, op een hoogte van 9-15 km, door kosmische straling. De aanwezigheid van koolstof (14C) in de atmosfeer en in levende organismen is vrijwel constant, maar neemt af in lichamen na de dood. Dit principe wordt gebruikt in koolstofdatering, die wordt gebruikt om de leeftijd van koolstofhoudende materialen met ouderdom tot ongeveer 40.000 jaar te bepalen.
De stabielste isotopen van koolstof
| Isotoop | NA | Halveringstijd | Verval via | Vervalenergie(MeV) | Verval product |
|---|---|---|---|---|---|
| Koolstof 11C | Synthetisch | 20min | β+ | 0.96 | 11B |
| Koolstof 12C | 98,9% | stabiel met 7 neutronen? | [/TD][TD] | [/TD] | |
| 1,1% | is stabiel met 7 neutronen? | [/TD][TD] | [/TD] | ||
| sporen | 5730 jaar | y β− | 0.15 | 14N |
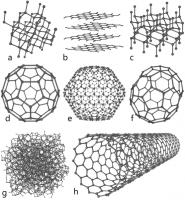 Allotrope vormen van koolstof : a) diamant, b) grafiet. c) Lonsdaleïet, d) fullereen (C60), e) C540, f) C70, g) amorf, h) nanobuis / Bron: Created by Michael Str?ck (mstroeck), Wikimedia Commons (CC BY-SA-3.0)
Allotrope vormen van koolstof : a) diamant, b) grafiet. c) Lonsdaleïet, d) fullereen (C60), e) C540, f) C70, g) amorf, h) nanobuis / Bron: Created by Michael Str?ck (mstroeck), Wikimedia Commons (CC BY-SA-3.0)Allotropen
Koolstof gestabiliseerd in verschillende atomaire structuren, de zogenaamde allotropen. De drie bekende allotropen zijn amorfe koolstof, grafiet en diamant. De amorfe vorm is een verzameling koolstofatomen in een niet-kristallijne toestand. Het is aanwezig als een poeder, en is het voornaamste bestanddeel van stoffen zoals lampzwart (roet) en actieve kool. Bij normale druk neemt koolstof de vorm van grafiet aan, elk atoom is gebonden aan drie andere en vormen zo een 2-dimensionale vlak bestaande uit hexagonale ringen. De vlakke platen worden gestapeld en onderling gebonden door zwakke van der Waals krachten, waardoor de platen gemakkelijk langs elkaar glijden, hetgeen de zachtheid van grafiet verklaart. De losse vlakke, een atoom dikke platen, noemt men grafeen.Bij zeer hoge druk vormt koolstof de compacte allotroop diamant, met bijna twee keer de dichtheid van grafiet. Hier is elk atoom tetraedrisch gebonden aan vier andere, waardoor een 3-dimensionaal netwerk ontstaat. Door de kracht van de koolstof-koolstof bindingen, vormt het netwerk de hardste natuurlijke stof. In tegenstelling tot het gezegde "diamonds are forever", zijn diamanten instabiel en worden op de lange duur omgezet in grafiet. Vanwege een hoge activeringsenergie barrière (energiedrempel), is de overgang naar grafiet extreem traag bij kamertemperatuur zodat we het in een mensenleven niet merken.
Onder bepaalde omstandigheden, kristalliseert koolstof uit als lonsdaleite. Deze vorm heeft een hexagonaal kristalrooster waar alle atomen covalent (d.w.z. atomen delen hun valentie elektronen) gebonden zijn. Daarom liggen de eigenschappen van lonsdaleite dicht bij die van diamant.
De verschillende allotropen van koolstof behoren tot de hardste natuurlijke stoffen in de vorm van diamant en tot de zachtste stoffen in de vorm van grafiet. Bovendien heeft het bindingsaffiniteit met andere atomen, inclusief andere koolstofatomen en kan meerdere stabiele covalente bindingen vormen met dergelijke atomen. Koolstof heeft de hoogste sublimatiepunt (verdamping vanuit vaste toestand) van alle elementen, namelijk ongeveer 3900 K. Het reageert niet met zwavelzuur, zoutzuur, chloor of alkaliën. Bij verhoogde temperaturen reageert koolstof met zuurstof tot koolstofoxiden, deze exothermische reactie wordt gebruikt in de ijzer- en staalindustrie om het koolstofgehalte van staal te regelen:
- Fe3O4 + 4 C (s) → 3 Fe (s) + 4 CO (g)
Koolstof gecombineerd met sommige metalen bij hoge temperaturen vormen metaalcarbiden, zoals ijzercarbide (cementiet) in staal. Wolfraamcarbide wordt gebruikt als schuurmiddel en voor het maken van snijgereedschappen.
 / Bron: AlexanderAlUS, Wikimedia Commons (CC BY-SA-3.0)
/ Bron: AlexanderAlUS, Wikimedia Commons (CC BY-SA-3.0)Grafeen
Recente proeven tonen aan dat grafeen tot de sterkste materialen behoort. Grafeen is een laag koolstofatomen die slechts een atoom dik is. Grafiet is een opeenstapeling van deze lagen grafeen. Grafeen is vele malen sterker dan High strength steel (HSS). Het is tevens één van de snelste halfgeleiders (honderd keer sneller dan silicium).Fullereen
Fullereen is een molecuul die uit koolstof atomen bestaat. Het heeft de vorm van een holle bol, ellipsoïde of buis. Bolvormige fullerenen worden wel buckyballen genoemd en cilindrische fullerenen, buckybuizen of nanobuizen. De kleinste buckybal is C60, en bestaat uit 60 koolstof atomen.De eigenschappen van koolstof zijn sterk afhankelijk van de kristalstructuur
- Synthetische diamant is het hardste materiaal. Grafiet is een van de zachtste materialen.
- Diamant is de ultieme schuurmiddel. Grafiet is een goed smeermiddel
- Diamant is een uitstekende elektrische isolator.Grafiet is een geleider van elektriciteit.
- Sommige vormen van grafiet worden gebruikt voor thermische isolatie, andere vormen zijn goede thermische geleiders.
- Diamant is transparant. Grafiet is ondoorzichtig.
- Diamond kristalliseert in het kubische atoomrooster. Grafiet kristalliseert in het hexagonale atoomrooster.
Het voorkomen van het element koolstof
Koolstof is de vierde meest voorkomende chemische element in het heelal na waterstof, helium en zuurstof. Koolstof is aanwezig in de zon, kometen en in de atmosfeer van planeten. Sommige meteorieten bevatten microscopisch kleine diamanten die zijn gevormd toen het zonnestelsel nog een protoplanetaire schijf was (d.w.z. de zon en de planeten moesten nog uit deze schijf gevormd worden). Microscopische diamant kan ook worden gevormd door de intense druk en temperatuur op de plaatsen van meteorietinslagen. Grafiet wordt gevonden in de Verenigde Staten, Rusland, Mexico, Groenland, en India. De meeste diamant afzettingen zijn in Afrika, met name in Zuid-Afrika, Namibië, Botswana, Republiek Congo, en Sierra Leone. Er zijn ook deposito's in Arkansas, Canada, Russisch noordpoolgebied, Brazilië en Australië.Koolstofcyclus
De hoeveelheid koolstof op aarde is constant. De weg die koolstof volgt in het milieu heet koolstofcyclus. Planten halen kooldioxide uit de omgeving. De planten worden gegeten door dieren, de koolstof wordt uitgeademd door dieren als kooldioxide. die deels oplost in de oceanen; dode plant en dier wordt turf, aardolie of steenkool, die wordt door de mens verbrandt waardoor de koolstof weer vrijkomt voor gebruik door planten enz.Organische Verbindingen
Koolstof kan zeer lange ketens van onderling verbonden koolstof atomen vormen. Koolstof-koolstof bindingen zijn sterk en stabiel. Deze eigenschap maakt het mogelijk met koolstof een bijna oneindig aantal verbindingen te vormen. De eenvoudigste vorm van een organisch molecuul is koolwaterstof, organische moleculen die bestaan uit waterstofatomen gebonden aan een keten van koolstofatomen. Koolstof komt voor in al het organische leven. Koolstof met waterstof vormen koolwaterstoffen die belangrijk zijn als koelmiddel, smeermiddel, oplosmiddel, chemische grondstof voor de vervaardiging van kunststof, petrochemie en fossiele brandstoffen.Koolstof met waterstof en zuurstof, vormt groepen biologische verbindingen zoals suikers, alcoholen, vetten en aromatische esters. Met toevoeging van stikstof vormen zich alkaloïden en met de toevoeging van zwavel ook antibiotica, aminozuren, en rubber producten. Met de toevoeging van fosfor aan deze elementen, worden DNA en RNA gevormd en adenosine trifosfaat (ATP), de belangrijkste energie overdracht molecuul in levende cellen.
Anorganische Verbindingen
Tot de bekendste anorganische verbindingen behoort kooldioxide (CO2). In water opgelost, vormt het koolzuur (H2CO3), door middel van dit tussenproduct, worden carbonaat ionen geproduceerd. Koolstofmonoxide (CO) wordt gevormd door onvolledige verbranding en is een kleurloos en reukloos gas. De moleculen bevatten een drievoudige binding, wat resulteert in de neiging zich permanent aan hemoglobine moleculen in het bloed te binden en zo de zuurstof opname te belemmeren. Zeer bekend is ook siliciumcarbide (SiC), een slijpmiddel die op diamant lijkt. Het is ook bekend als carborundum, dat veel wordt gebruikt in de vorm van slijpstenen, polijst- en slijppoeders en als bekleding van schuurpapier, en voor pantsering van pantservoertuigen.Productie
Er zijn drie types van natuurlijk grafiet namelijk amorf, kristallijne vlokgrafiet, en ader- of klompgrafiet. Amorf grafiet is de laagste kwaliteit en de meest voorkomende. Amorf grafiet is te vinden in China, Europa, Mexico en de Verenigde Staten. Vlokgrafiet is zeldzamer dan amorfgrafiek. Goede kwaliteit vlokgrafiet kan worden verwerkt tot grafiet voor vele toepassingen, zoals vlamvertragers. De belangrijkste vondsten zijn in Oostenrijk, Brazilië, Canada, China, Duitsland en Madagaskar. Adergrafiet is zeldzaam en deze hoogste kwaliteit natuurlijk grafiet wordt commercieel gewonnen in Sri Lanka. Het erts wordt gemalen, waarbij moet worden voorkomen dat grotere diamant wordt vernietigd, vervolgens worden de deeltjes gesorteerd op dichtheid. De meeste van deze mijnen zijn gevestigd in Canada, Zimbabwe, Angola, en één in Rusland.Toepassingen
- Het belangrijkste economisch gebruik van koolstof anders dan in levensmiddelen en hout is in de vorm van koolwaterstoffen, met name de fossiele brandstof methaangas en ruwe olie (aardolie). Ruwe olie is het uitgangspunt van een eindeloze reeks van producten.
- Cellulose is een natuurlijke, koolstof bevattend polymeer uit planten in de vorm van katoen, linnen. Cellulose wordt hoofdzakelijk gebruikt voor het handhaven structuur in planten. Van de waardevolle koolstofpolymeren van dierlijke oorsprong wordt wol, kasjmier en zijde gemaakt.
- Kunststoffen zijn gemaakt van synthetische polymeren. Koolstof, vaak met zuurstof- en stikstofatomen zijn opgenomen in de hoofdketen van het polymeer.
- Grafiet wordt gemengd met klei gebruikt in potloden.
- Het wordt gebruikt als een smeermiddel en pigment.
- Gebruikt als elektroden voor droge batterijen en in het galvaniseren en elektroformeren.
- Gebruikt als (kool)borstels voor elektrische motoren.
- Hout, kolen en olie worden gebruikt als brandstof voor de productie van energie en ruimteverwarming.
- Edelsteen kwaliteit diamant wordt gebruikt in sieraden, en industriële diamanten worden gebruikt in boren, slijpen en polijsten gereedschappen voor de bewerking van metalen en steen.
- Kunststoffen worden gemaakt uit fossiele koolwaterstoffen, en koolstofvezel, gemaakt door pyrolyse van synthetische vezels van polyester wordt gebruikt om plastic te versterken tot geavanceerde, lichtgewicht composietmaterialen te vormen.
- Koolstofvezel is gemaakt door pyrolyse van geëxtrudeerd en uitgerekt filamenten van polyacrylonitril (PAN) en andere organische stoffen. Het resultaat is vezels met hogere treksterkte dan staal.
- Roet wordt gebruikt als het zwarte pigment in drukinkt, olieverf, carbonpapier, Oost-Indische inkt en toner voor laserprinter. Roet wordt ook gebruikt als vulstof in rubber en in plastic samenstellingen. Actieve kool wordt gebruikt als een absorberende en adsorberende in filtermateriaal in toepassingen zo divers als gasmaskers, waterzuivering en afzuigkappen voor keukens en in de geneeskunde aan toxines, giftige stoffen, of gassen te absorberen
- Koolstof wordt gebruikt voor chemische reductie bij hoge temperaturen. Zoals het reduceren van ijzererts tot ijzer.Belangrijke toepassingen van grafiet vinden we in de staalindustrie (grafietelektroden, smeltkroezen, vuurvaste bakstenen) en bij de productie van lithium-ion batterijen (anodes). Toepassing als legeringselement in (koolstof) staal is zeer bekend. Harden van staaloppervlak door het verhitten stalen onderdelen in koolstofpoeder. Carbiden van silicium, wolfraam, boor en titaan, behoren tot de hardste materialen en worden gebruikt als schuurmiddel in snij- en slijpgereedschap.
Het element koolstof voor de volksgezondheid en milieu
- Zuivere koolstof (grafiet, houtskool) is niet toxisch en kan veilig ingenomen worden. Het is bestand tegen de zure inhoud van het spijsverteringskanaal.
- Het inademen van stof van kolen, roet of van diamant in grotere hoeveelheid kan gevaarlijk zijn, het irriteert de longweefsel en veroorzaakt longziektes.
- In nucleaire toepassingen waarbij grafiet wordt gebruikt als neutron moderator.(vertraagd de snelheid van neutronen in een kernreactor)
- De grote verscheidenheid aan koolstofverbindingen omvatten onder andere dodelijke vergiften als tetrodotoxine, lectine ricine, cyanide (CN) en koolmonoxide (CO).