De werking van een lampje in een reddingsvest
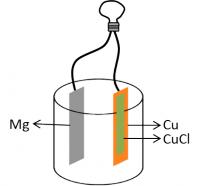
 Reddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden met een magnesiumstrip en een koperstrip waarop wat slecht oplosbaar koperchloride is aangebracht. Deze koper-magnesiumstructuur vormt de batterij voor het lampje. Pas zodra het reddingsvest in het water belandt, gaat het lampje branden. De stroom voor het lampje wordt geleverd door het optreden van een redoxreactie tussen magnesium en koper(I)-ionen.
Reddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden met een magnesiumstrip en een koperstrip waarop wat slecht oplosbaar koperchloride is aangebracht. Deze koper-magnesiumstructuur vormt de batterij voor het lampje. Pas zodra het reddingsvest in het water belandt, gaat het lampje branden. De stroom voor het lampje wordt geleverd door het optreden van een redoxreactie tussen magnesium en koper(I)-ionen.
- Redoxreacties
- Sterkte van oxidatoren en reductoren
- Een galvanische cel (batterij)
- Betrokken redoxkoppels in het lampje
- De werking van het lampje
Redoxreacties
Een redoxreactie is een reactie tussen een oxidator (Stel: Ox1) en een reductor (Stel: Red2). De reductor geeft hierbij elektronen (e-) af aan de oxidator. Je kan een redoxreactie opsplitsen in twee deelreacties: de oxidatie (afgave van elektronen) en de reductie (opname van elektronen).- Reductie: Ox1 + ne- ↔ Red1 De oxidator (Ox1) wordt hierbij omgezet in een reductor (Red1).
- Oxidatie: Red2 ↔ Ox2 + ne- De reductor (Red2) wordt hierbij omgezet in een oxidator (Ox2).
De globale reactie is hier: Ox1 + Red2 ↔ Red1 + Ox2
Sterkte van oxidatoren en reductoren
Hoe goed bovenstaande redoxreactie opgaat, hangt af van het oxiderend vermogen van Ox1 en het reducerend vermogen van Red2. Hoe groter het oxiderend vermogen van Ox1 in vergelijking met dat van Ox2 en hoe grotere het reducerend vermogen van Red2 in vergelijking met dat van Red1, hoe beter bovenstaande redoxreactie zal opgaan.De sterkte van het oxiderend vermogen van een oxidator en het reducerend vermogen van een reductor van een redoxkoppel kan worden afgeleid uit de normpotentiaal van dat redoxkoppel. Een hoge normpotentiaal wijst op een sterke oxidator en een lage normpotentiaal wijst op een sterke reductor.
Een galvanische cel (batterij)
Bij een galvanische cel gaan de oxidatie en de reductie door aan twee elektroden die met elkaar zijn verbonden door een geleidende draad. Aan de negatieve elektrode (anode) gaat de oxidatie door en aan de positieve elektrode (kathode) treedt de reductie op. De elektronen die worden afgegeven tijdens de oxidatie bewegen vanaf de anode via de geleidende draad naar de kathode waar ze tijdens de reductie worden opgenomen. Er ontstaat dus een elektrische stroom in de geleidende draad. Als er dus bijvoorbeeld een lampje wordt geschakeld binnen deze geleidende draad krijgt dit elektrische energie en kan het dus branden.Betrokken redoxkoppels in het lampje
Mg2+ en Cu+ beiden oxidatoren en Mg en Cu beiden reductoren zijn. Op basis van de normpotentialen van deze koppels kan worden afgeleid welk koppel de sterkste oxidator en welk koppel de sterkste reductor kan leveren.
- E°(Mg2+/Mg) = -2.380V
- E°(Cu+/Cu) = 0.521V
Het magnesiumkoppel heeft een veel lagere normpotentiaal dan het koperkoppel. Mg is dus een veel sterkere reductor dan Cu en Cu+ is dus een veel sterkere oxidator dan Mg2+.
- Mg zal dus gemakkelijker elektronen afgeven in vergelijking met Cu en omgezet worden in Mg2+: Mg → Mg2+ + 2e-
- Cu+ zal dus gemakkelijker elektronen opnemen dan Mg2+ en worden omgezet in Cu: Cu+ + 1e- → Cu
Wanneer Mg in contact komt met een Cu+-oplossing zal het dus elektronen afgeven aan Cu+. Een Mg atoom reageert met 2Cu+ ionen omdat het aantal afgegeven en het aantal opgenomen elektronen gelijk moet zijn: Mg + 2Cu+ → Mg2+ + 2Cu.
De werking van het lampje
Indien het reddingsvest droog blijft, zal het lampje niet branden. Er is immers geen contact tussen de magnesium- en de koperstrip. De lucht tussen beide strips is immers te weinig geleidend voor elektrische stroom. Indien het reddingsvest in het water terecht komt, zal het kokertje, waarin de metaalstrips zich bevinden, zich vullen met water. Hierdoor wordt er elektrisch contact gemaakt tussen beide strips. De opgeloste ionen in het water zorgen er immers voor dat de stroomkring wordt gesloten.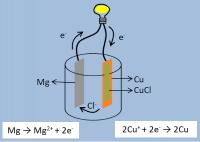
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 De alkaline batterij, chemisch uitgelegdEen batterij is een galvanische cel of een groep galvanische cellen die in serie verbonden zijn en die in een zodanige v…
De alkaline batterij, chemisch uitgelegdEen batterij is een galvanische cel of een groep galvanische cellen die in serie verbonden zijn en die in een zodanige v…
 Bepaling van normpotentialenElke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is e…
Bepaling van normpotentialenElke redoxkoppel wordt gekenmerkt door een normpotentiaal, ook standaard redoxpotentiaal genoemd. De normpotentiaal is e…
 Galvanische cel versus elektrolytische celEen galvanische en een elektrolytische cel zijn beiden gebaseerd op redoxreacties waarvan beide halfreacties doorgaan in…
Galvanische cel versus elektrolytische celEen galvanische en een elektrolytische cel zijn beiden gebaseerd op redoxreacties waarvan beide halfreacties doorgaan in…
 Atoomabsorptie- en atoomemissiespectrofotometrie (AAS/AES)Atoomabsorptiespectrofotometrie (AAS) en atoomemissiespectrofotometrie (AES) zijn zeer specifieke spectrofotometrische m…
Atoomabsorptie- en atoomemissiespectrofotometrie (AAS/AES)Atoomabsorptiespectrofotometrie (AAS) en atoomemissiespectrofotometrie (AES) zijn zeer specifieke spectrofotometrische m…
 De invloed van hard water op wasprocessen en toestellenWater dat rijk is aan oplosbare calcium (Ca)- en magnesium (Mg)-zouten en dus veel calcium- en magnesium-ionen bevat, no…
De invloed van hard water op wasprocessen en toestellenWater dat rijk is aan oplosbare calcium (Ca)- en magnesium (Mg)-zouten en dus veel calcium- en magnesium-ionen bevat, no…
Gerelateerde artikelen
Zeilen met kinderen - veiligheid aan boordWanneer is een schip veilig genoeg voor kinderen? Met andere woorden, welke aspecten zorgen ervoor dat je kinderen met e…
Bronnen en referenties
- Inleidingsfoto: DistelAPPArath, Pixabay
- Analytical chemistry, Skoog, West en Holler.
Guust2016 (74 artikelen)
Laatste update: 21-10-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Laatste update: 21-10-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 2
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.