Thorium: Het element
 Thorium, genoemd naar Thor de god van de donder, is in 1828 ontdekt door de Zweed Jöns J Berzelius. Thorium is goedkoper dan uranium en thoriumreactoren produceren veel minder nucleair afval dan uraniumreactoren. De kans op een kernsmelting à la Fukushima is met een thoriumreactor met gesmolten zout als koeling onmogelijk. Er is genoeg thorium om de wereld honderdduizend jaar van energie te voorzien. Als we NU de bouw starten hebben we over twintig jaar geen olie meer nodig. In 1999 vroegen onderzoekers de Europese Commissie om geld om thoriumreactoren te ontwikkelen. Brussel kreeg een negatief advies van de bestaande Europese nucleaire industrie.
Thorium, genoemd naar Thor de god van de donder, is in 1828 ontdekt door de Zweed Jöns J Berzelius. Thorium is goedkoper dan uranium en thoriumreactoren produceren veel minder nucleair afval dan uraniumreactoren. De kans op een kernsmelting à la Fukushima is met een thoriumreactor met gesmolten zout als koeling onmogelijk. Er is genoeg thorium om de wereld honderdduizend jaar van energie te voorzien. Als we NU de bouw starten hebben we over twintig jaar geen olie meer nodig. In 1999 vroegen onderzoekers de Europese Commissie om geld om thoriumreactoren te ontwikkelen. Brussel kreeg een negatief advies van de bestaande Europese nucleaire industrie.
Het element thorium algemeen
| naam | symbool | atoomnummer | groep | periode | blok | reeks | kleur |
|---|---|---|---|---|---|---|---|
| thorium | Th | 90 | scandium groep | periode 7 | blok F | actiniden | zilver wit |
Chemische eigenschappen
| atoommassa | elektronenconfiguratie | oxidatietoestanden | elektronegativiteit | atoomstraal (pm) | ionisatiegraad KJ/mol |
|---|---|---|---|---|---|
| 232 | [Rn]6d2 7s2 | +4 | 1,4 (Pauli) | 180 | 1e 609 2e 1110 3e 1930 |
Fysische eigenschappen
| dicht- heid (g/cm3) | smelt- punt (K) | kook- punt (K) | aggregatie toestand | smelt- warmte (KJ/mol) | verdampings- warmte (KJ/mol) | kristal- structuur | specifieke warmte (J/m.K) | elektrische weerstand (μΩ•cm) | warmte- geleiding (W/m.K) |
|---|---|---|---|---|---|---|---|---|---|
| 11,7 | 2023 | 5000 | vast | 19 | 525 | kubisch | 120 | 13 | 54 |
Voorkomen op aarde
De totale hoeveelheid thorium op aarde is minimaal viermaal zo groot als de hoeveelheid uranium. Belangrijke thoriumertsen zijn, thorianiet en monaziet die tot 12% thoriumoxide kunnen bevatten.Winning van thorium
Bij vloeistof extractie wordt gewerkt met twee niet mengbare vloeistoffen, waarbij de te onttrekken stof in één van de vloeistoffen oplost. In geval van kleine verschillen tussen de te scheiden stoffen, kan men de fracties opnieuw bewerken en tenslotte toch een goede scheiding realiseren.Meest stabiele isotopen
Hoewel er van thorium geen stabiele isotopen bestaan, is er één met een lange halveringstijd, namelijk 232Th die een halveringstijd heeft van 1,405•10↑10 jaar, dat is ongeveer de leeftijd van het heelal en kan dus als stabiel worden beschouwd.| isotoop | 228Th | 229Th | 230Th | 232Th |
|---|---|---|---|---|
| halveringstijd jaar | 1,91 | 7880 | 7,54.10↑4 | 1,41.10↑10 |
| vervalwijze | alfa | alfa | alfa | alfa |
| vervalenergie (MeV) | 5,52 | 5,17 | 4,77 | 4,08 |
| voorkomen | synthetisch | synthetisch | synthetisch | natuurlijk |
| vervalproduct | 224Ra | 225Ra | 226Ra | 228Ra |
Gebruikseigenschappen van thorium
Het element thorium is zacht, zilverwit en goed te bewerken. Het is vrij stabiel aan de lucht. Het metaal zelf wordt niet veel toegepast. Van de oxiden heeft thorium(1V) oxide (ThO2) het hoogste smeltpunt (3300°C). Bij hoge temperatuur brandt thorium met een witte vlam. Meest voorkomende oxidatietoestand is +IV (Th4+), er komen ook lagere oxidatietoestanden voor.Thorium als kernbrandstof
Al aan het eind van de jaren ’40 hadden Amerikaanse fysici door wat thorium voor de wetenschap kon betekenen. Het brengt namelijk meer op en de verwerking ervan is goedkoper, maar de Verenigde Staten hadden het plutonium (een afvalproduct van de uraniumreactoren) nodig om kernwapens te maken.Verschil tussen thorium en uranium
- Thorium kan, even als uranium en plutonium worden gebruikt als brandstof in kernreactoren. Thorium vormt na absorptie van neutronen de uraniumisotoop 233U, die splijtbaar is. 233U levert bij splijting meer neutronen per geabsorbeerd neutron op dan de tot nu gangbare uranium en plutonium(235U en 239Pu). Thorium wordt in tegenstelling van uranium bijna geheel in de reactor verbrand en er is daarom veel minder afval en de radioactieve afval heeft een halveringstijd van 500 jaar i.p.v. de halveringstijd van 100000 jaar van de afval van de uraniumreactor.
- Meeste thoriumreactoren die heden gebouwd worden gebruiken combinatie van brandstof, omdat de ingenieurs dan de ervaring met de bestaande reactoren kunnen gebruiken. India bouwt Canadese Candu reactoren, waarin thorium gecombineerd wordt met plutonium en uranium. op termijn wil India alleen thorium gebruiken omdat het grote voorraden heeft en niet afhankelijk wil zijn van import. In reactors als de Canadese CANDU-6 wordt thorium gebruikt in combinatie met plutonium-239.
- Het kweekproces verloopt als volgt: Het 232Th absorbeert een neutron onder vorming van 233Th waarbij een elektron en een antineutrino ( ) vrijkomt. Door bètaverval gaat dat over in protactinium 233 (233Pa), dat weer een elektron en een antineutrino uitzendt onder vorming van 233U: Het reactieproduct wordt vervolgens buiten de reactor gescheiden: de 233U kan relatief eenvoudig (langs chemische weg) worden gescheiden van thorium en in de reactor geplaatst.
- Het productieproces heeft nadelen: de fractie met 233U is hoog radioactief door verontreiniging met het zeer radioactieve 232U en daarom lastig te hanteren. Bij het hergebruiken van de thoriumfractie is er een probleem met het hoogradioactieve 228Th.
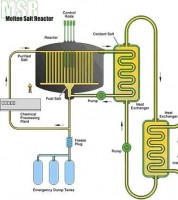 Afbeelding 2: MSR reactor - klikken voor vergroting - de hete gasleiding en afgewerkt gasleiding rechtsonder in de afbeelding lopen respectievelijk naar en van de turbine die de electriciteitsgenerator aandrijft / Bron: US Department of Energy Nuclear Energy Research Advisory Committee, Wikimedia Commons (Publiek domein)
Afbeelding 2: MSR reactor - klikken voor vergroting - de hete gasleiding en afgewerkt gasleiding rechtsonder in de afbeelding lopen respectievelijk naar en van de turbine die de electriciteitsgenerator aandrijft / Bron: US Department of Energy Nuclear Energy Research Advisory Committee, Wikimedia Commons (Publiek domein)China en Japan gaan uit van een gesmolten-zout- thoriumreactor. India gaat uit van een zwaarwaterreactor op basis van thorium.
Een van de voordelen van element 90 (thorium) boven element 92 (uranium) is dat de aardkorst minimaal viermaal zoveel thorium als uranium bevat. Een ander voordeel is dat thorium energierijker is en dat de reactor afval minder problemen oplevert.
Helaas zijn de gebruikte gesmolten zouten corrosief. Inmiddels draait een testreactor vijf jaar zonder ernstige corrosie, door toepassing van de legering Hastelloy-N. De niet opgeloste corrosie problemen vertragen de bouw van MRS thoriumreactoren.
Waarom we nog geen thoriumcentrales hebben
Naast de corrosie is de belangrijkste reden dat we geen thoriumreactoren hebben dat kernenergie voortkomt uit de uranium/plutonium kernwapen technologie. De eerste toepassing als krachtbron was een atoomonderzeeër en een bommenwerper. Alle nucleaire kennis was gebaseerd op het Manhatten project en een functie van de eerste centrales was het produceren van plutonium om kernwapens te maken. Daarom werd voor uranium 238 gekozen als splijtstof. Toen de wereld door de oliecrisis in 1973 kernenergie centrales gingen bouwen koos men wegens de aanwezige kennis voor uranium.Andere toepassingen van thorium dan kernenergie
- Voor het coaten van wolfraam draad in de elektronica, omdat het een hoge elektronenemissie heeft.
- Als legeringselement in magnesium voor verhoogde corrosiebestendigheid, grotere sterkte en betere kruipbestendigheid bij hoge temperaturen.
- Als toevoeging aan glas zorgt thorium voor hogere brekingsindex en lage dispersie..het glas wordt gebruikt voor hoge kwaliteit camera lenzen en wetenschappelijke instrumenten
- Als katalysator is thoriumoxide geschikt voor de productie van salpeterzuur en zwavelzuur en bij de raffinage van aardolie.
- Aan de hand van de uranium-thorium concentratie is de ouderdom van fossielen te bepalen.
- Een gloeikousje van gaslampen gevuld met thoriumoxide (ThO2) die bij verhitting een verblindend wit licht geeft. Vroeger als gasverlichting in steden, heden o.a. in kampeerlampen en petroleumlampen.
- Thoriumoxide wordt gebruikt om de korrelgrootte te beheersen van wolfraam voor elektrische lampen
- Thoriumoxide wordt gebruikt voor hoge-temperatuur-laboratorium smeltkroezen.
- Aan de hand van de uranium-thorium concentratie is de ouderdom van fossielen te bepalen.
Gezondheid en milieu
- Thorium is zwak radioactief, vervalproducten van thorium kunnen gevaarlijker zijn. Thorium vervalt in 6 alfa- en 4 bèta stappen tot 208Pb, meest stabiele isotoop van lood (de thoriumreeks).
- Gezondheidsrisico van thorium wordt gevormd door de stof zelf. Bij inname hoopt het zich op in milt, lever, bot en lymfesysteem, met een biologische halveringstijd van 22 jaar verhoogt het de kans op leukemie en leverkanker.
- Mensen worden altijd aan kleine hoeveelheden thorium blootgesteld via de lucht, water en voedsel, omdat het overal op aarde voorkomt. Mensen absorberen thorium via het voedsel of drinkwater, opname via de lucht is onder normale omstandigheden te verwaarlozen. Maar het het inademen van grote hoeveelheden thorium kan dodelijk zijn, men sterft dan aan metaalvergiftiging.
- Er worden grotere hoeveelheden thorium gevonden bij stortplaatsen waardoor de plaatselijke bewoners een grotere hoeveelheid thorium binnen krijgen door inademen en omdat thorium terecht komt in het voedsel.
- Het inademen van thorium in de mijnbouw of de thoriumindustrie, kunnen te veel thorium binnen krijgen en vergroot de kans op de ontwikkeling van long- en alvleesklierkanker. Het licht radioactieve thoriumstof wordt in o.a. de botten opgeslagen en kan vele jaren na de besmetting nog kanker veroorzaken.
© 2014 - 2025 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Kernenergie met uranium of gesmolten-zout-reactor?Kernenergie is emissieloze energie. Geen luchtvervuiling en geen uitstoot van koolstofdioxide. Toch bestaat er een felle…
Kernenergie met uranium of gesmolten-zout-reactor?Kernenergie is emissieloze energie. Geen luchtvervuiling en geen uitstoot van koolstofdioxide. Toch bestaat er een felle…
 Vervalreeksen opstellen - theorie en voorbeeldenIndien er wordt gesproken over deeltjesfysica, heeft men het vaak over radioactiviteit. Radioactiviteit is overal, en he…
Vervalreeksen opstellen - theorie en voorbeeldenIndien er wordt gesproken over deeltjesfysica, heeft men het vaak over radioactiviteit. Radioactiviteit is overal, en he…
 Thorium als kernenergie: minder kernafval dan uranium?Kernenergie kan een duurzaam alternatief zijn door lage CO2-uitstoot maar niet zonder nadelen. Energie produceren door k…
Thorium als kernenergie: minder kernafval dan uranium?Kernenergie kan een duurzaam alternatief zijn door lage CO2-uitstoot maar niet zonder nadelen. Energie produceren door k…
 Francium: Het elementFrancium is in 1939 ontdekt door de Franse fysicus Marguerite Perey. Zij ontdekte het element tijdens het bestuderen van…
Francium: Het elementFrancium is in 1939 ontdekt door de Franse fysicus Marguerite Perey. Zij ontdekte het element tijdens het bestuderen van…
 De hardheidsschaal van MohsWe vergelijken de hardheid van vaste stoffen door met de ene stof op de andere te krassen. Hierop is de hardheidsschaal…
De hardheidsschaal van MohsWe vergelijken de hardheid van vaste stoffen door met de ene stof op de andere te krassen. Hierop is de hardheidsschaal…
 Wat is een brandstofcel?De brandstofcel is een serieus alternatief voor de bestaande verbrandingsmotoren, die gebruikt worden in auto's en elekt…
Wat is een brandstofcel?De brandstofcel is een serieus alternatief voor de bestaande verbrandingsmotoren, die gebruikt worden in auto's en elekt…
Gerelateerde artikelen
Bronnen en referenties
- http://www.scientias.nl/thorium-kan-olie-binnen-vijf-jaar-overbodig-maken/15378
- http://w ww.volkskrant.nl/vk/nl/2664/Nieuws/article/detail/3373762/2013/01/08/Azie-werkt-aan-energiewonder-van-thorium.dhtml
- http://nl.wikipedia.org/wiki/Thorium
- http://www.webelements.com/thorium/
- http://viatienen.be/college/new/downloads1011/lln/PS%20Fedichem/glos_nl.cfm-LID=E.htm#extractie
- http://www.lenntech.nl/periodiek/elementen/th.htm#ixzz30YHQNmSX
- http://bharatkalyan97.blogspot.nl/2012/09/great-thorium-robbery-impacting-india.html (afbeeldingen)
- Afbeelding bron 1: US Department of Energy Nuclear Energy Research Advisory Committee, Wikimedia Commons (Publiek domein)
Custor (173 artikelen)
Laatste update: 04-04-2015
Rubriek: Wetenschap
Subrubriek: Techniek
Bronnen en referenties: 8
Laatste update: 04-04-2015
Rubriek: Wetenschap
Subrubriek: Techniek
Bronnen en referenties: 8
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.