Hoe is een atoom opgebouwd?
Een atoom, het kleinste bouwsteentje van elk element dat we kennen. Vrijwel alle eigenschappen van de materie op de wereld hangt af van de eigenschappen van de atomen. Alles wat je tegenkomt zijn opgebouwd uit atomen dus ook de stoel waar je op zit. En zelfs je eigen lichaam!Bouw van een atoom
Een atoom bestaat uit protonen, elektronen en neutronen. De protonen en neutronen bevinden zich in de kern van het atoom de atoomkern. De elektronen zitten in de elektronenwolk op een grote afstand van de kern af. Dit word het atoommodel van Rutherford genoemd. Een atoom is ongeveer 0,0000000001 meter groot dat is 10 tot de macht -10. Dat is zo ontzettend klein dat een atoom met geen enkel hulpmiddel gezien kan worden. Alleen als ze met vele miljarden bij elkaar zijn worden ze zichtbaar. Er zijn ongeveer 100 verschillende soorten atomen op aarde. Elk atoom heeft een verschillend aantal protonen in de kern, dit betekent dus ook dat ze een verschillend aantal elektronen hebben in de elektronenwolk. Zo heeft een koolstof atoom zes protonen in de kern en een uraniumatoom 92. Het atoomnummer van een atoomsoort geeft de aantal protonen in de kern aan dit atoomnummer is te vinden in een perodiek systeem der elementen.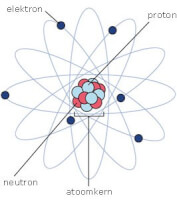
Protonen, neutronen, elektronen
Een atoom heeft een lading. Deze lading komt doordat protonen die in de kern zijn positief zijn. En de elektronen negatief. Deze samen opgeteld geeft de lading van de atoom weer. Neutronen hebben echter geen lading, deze worden neutraal genoemd.Isotopen
Van de meeste atoomsoorten komen atomen voor met een verschillend aantal neutronen. Het aantal protonen en elektronen is wel hetzelfde. Dit zijn isotopen. Omdat de eigenschappen van een atoomsoort voornamelijk bepaald wordt door het atoomnummer, hebben isotopen chemisch ongeveer de zelfde eigenschappen.
Massagetal
De atoomkern bestaat niet alleen uit protonen, maar ook uit neutronen. Dit zijn deeltjes die geen lading hebben. De massa van een neutron en elektron zijn aan elkaar gelijk. De massa is heel erg klein, omdat daarmee rekenen moeilijk is hebben scheikundigen een nieuwe massa-eenheid daarvoor bedacht, u. Dus de massa van een proton en neutron is gelijk aan 1 u. De massa van een elektron is 2000 maal zo klein en is dus verwaarloosbaar. De massa van een atoom hangt dus af van de atoomkern omdat de protonen en neutronen zich daar bevinden. Het massagetal van bijvoorbeeld natrium geef je weer als Na-23. Of het massagetal kan linksboven de atoomsymbool staan.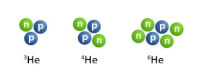
Rekenvoorbeeld
VraagHet massagetal van Natrium is 23. De atoomnummer van natrium is 11. Hoeveel neutronen zitten er in de kern van een natriumatoom?
Antwoord
Het massagetal is het aantal protonen plus het aantal neutronen. Je weet dat je 11 protonen hebt omdat het atoomnummer 11 is. Dus 23-11=12. Er zitten 12 neutronen in de atoomkern van een natrium atoom.