De 3 soorten stoffen (chemie)
 Er zijn 3 soorten stoffen vanuit de chemie: moleculaire stoffen, zouten en metalen. Hieronder staan alle drie de soorten beschreven en wordt uitgelegd waarom en hoe ze van elkaar verschillen. Tevens wordt er ingegaan op de werking van deze 3 soorten. Via schema's wordt duidelijk gemaakt hoe de stoffen precies in elkaar zitten. Om dit artikel te begrijpen is wel enige basiskennis nodig van de molecuultheorie. Dit artikel is bedoeld voor beginners en niet voor vergevorderde wetenschappers.
Er zijn 3 soorten stoffen vanuit de chemie: moleculaire stoffen, zouten en metalen. Hieronder staan alle drie de soorten beschreven en wordt uitgelegd waarom en hoe ze van elkaar verschillen. Tevens wordt er ingegaan op de werking van deze 3 soorten. Via schema's wordt duidelijk gemaakt hoe de stoffen precies in elkaar zitten. Om dit artikel te begrijpen is wel enige basiskennis nodig van de molecuultheorie. Dit artikel is bedoeld voor beginners en niet voor vergevorderde wetenschappers.Soorten stoffen
In de chemie wordt onderscheid gemaakt tussen: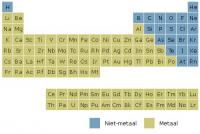 Het systeem der elementen
Het systeem der elementenMoleculaire stoffen
Dit zijn de stoffen die het meeste voorkomen in het dagelijks leven. Moleculaire stoffen zijn stoffen die zijn opgebouwd uit moleculen - zoals de term 'moleculair' al zegt. Moleculen bestaan uit atomen die op hun beurt weer zijn opgedeeld in een kern met eromheen elektronen. De kern bevat neutronen en protonen. Protonen zijn positief geladen en elektronen negatief. Neutronen hebben geen lading. In een normaal atoom zijn er altijd evenveel protonen als elektronen, dus is de lading van het hele atoom ALTIJD 0!Schematische opbouw:
Moleculaire stof > molecuul > atomen > kern (met protonen en neutronen) + elektronen
Eigenschappen:
Zouten
Zouten zijn opgebouwd uit zogenaamde ionen. Een ion is een atoom waarin de lading NIET gelijk is aan 0. Daarom spreken we in zouten ook niet over atomen maar over ionen. Zouten zijn opgebouwd uit metaal en een niet-metaal ionen. Een metaal ion neemt alijd een positieve lading aan (er gaan dus elektronen weg), maar een niet-metaal neemt altijd een negatieve lading aan. Dit is belangrijk om te weten bij het oplossen van zogenaamde verhoudingsformules en bij het oplossen van neerslagreacties, maar dat zullen we verder niet bespreken in dit artikel.Zouten zitten niet zoals een moleculaire stof in moleculen (en moleculen zitten op hun buurt in een molecuulrooster), maar in een zogenaamd ionrooster. De metaal en niet-metaal ionen wisselen elkaar regelmatig af.
Schematische opbouw:
Zout > ionrooster > metaal en niet-metaal ionen > atomen > kern (met protonen en neutronen) + elektronen
Eigenschappen:
Metalen
Metalen zitten in metaalroosters. Hierbij komen dus ook geen moleculen kijken. In een metaalrooster kunnen de elektronen vrij bewegen door het rooster. Hierdoor kan een metaal stroom geleiden. Een metaal is vaak te buigen zonder dat het hierbij breekt - in tegenstelling tot zouten en moleculaire stoffen - omdat de metaalatomen zo zijn geordend dat deze kunnen verschuiven in de stof. Als je een metalen liniaal buigt verplaatst je daarmee de metaalatomen waardoor het rooster niet meer regelmatig is. Daarom kan een metaal breken als je het te vaak buigt.Schematische opbouw:
Metaal > metaalrooster > metaalatomen (kern met protonen en neutronen) + elektronen die vrij bewegen door het rooster
Eigenschappen: