Scheikunde - De soorten bindingen en stoffen
In dit artikel worden de verschillende stoffen en bindingen in de scheikunde toegelicht. Welke stof heeft welke binding?Bindingen
AtoombindingBinding tussen atomen in een molecuul.
Voorbeeld: zuurstof(O2), 2 atomen die dus samen het molecuul zuurstof vormen!
Fvdw-binding
Binding tussen moleculen in een moleculaire stof (niet-metaal).
Voorbeeld: water(H2O), de binding tussen de H atomen en het zuurstof atoom heet dus de Fvdw-binding die de stof dus bij elkaar houdt!
Metaalbinding
Alleen bij metalen! Deze binding wordt bepaalt tussen de positief geladen protonen van een metaal en de negatief geladen elektronen. De kracht die deze stof bij elkaar houdt, is dus een metaalbinding.
Voorbeeld: Cu, wordt dus bij elkaar gehouden door de metaalbinding!
Ion-binding
Komt alleen voor bij zouten! Wordt bepaalt door het positieve metaal en het negatieve niet-metaal in een zout!
Voorbeeld: ZinkJodide(ZnI2), is dus Zn met lading 2+ en I met lading 2-, deze kracht hiertussen is dus de Ion-binding!
Covalentie
Covalentie is het aantal bindingen dat een niet-metaal kan hebben. In het Periodiek Systeem is dit na te gaan voor enkele elementen. Vanaf de meest rechterkolom is de covalentie = 0, dat is de groep met halogenen. De kolom links daarnaast heeft covalentie = 1, dus fluor, chloride en bromide hebben een covalentie = 1. De groep daarnaast heeft een covalentie = 2, die daarnaast covalentie = 3 en de groep daarnaast covalentie = 4. Koolstof heeft dus een covalentie = 4. Alleen de zojuist genoemde stoffen worden gebruikt in covalentie-vraagstukken. Ook waterstof(=H) speelt hier een belangrijke rol en heeft een covalentie = 1.
Voorbeeld: koolstofdioxide heeft als molecuulformule CO2. Als hiervan de structuurformule wordt getekend, wordt duidelijk waarom het CO2 is:
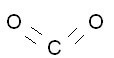
Stoffen
Moleculaire stoffenBestaan uit moleculen en hebben een Fvdw of een atoombinding!
Voorbeeld: H2O en O2
Metalen
Hebben altijd een metaalbinding en geleiden in vaste vorm altijd stroom door de geladen deeltjes in een metaal.
Voorbeeld: Cu en Fe
Zouten
Een zout bestaat uit een niet-metaal en een metaal. Zouten hebben altijd een ion-binding! Een zout geleid stroom nadat het is opgelost in water. Daarna zal het zout zich splitsen in losse positief geladen metaaldeeltjes en negatief geladen niet-metaaldeeltjes. Hierdoor is stroomgeleiding mogelijk!
Voorbeeld: natriumchloride, beter bekend als keukenzout, heeft als molecuulformule: NaCl. Het natrium en het chloride wordt bij elkaar gehouden door een ion-binding. Het zout is dus neutraal, dat komt omdat in dit geval natrium een lading heeft van 1+ en het chloride een lading van 1-, samen dus neutraal = 0! Het zout geleid in vaste fase geen stroom, in opgeloste fase wel. Wanneer een zout wordt opgelost in water, ontstaan in dit geval dus losse Na+ en Cl- -ionen die in het water vrij bewegen, deze zorgen ervoor dat stroomgeleiding dus mogelijk is in opgeloste fase!