Organische en anorganische chemie
Binnen de chemie (scheikunde) houdt men zich bezig met allerlei chemische verbindingen. Deze verbindingen bestaan uit verschillende atomen die voorkomen op aarde. Er wordt een onderscheid gemaakt in organische en anorganische chemie. Op het oog lijken alleen de letters a en n toegevoegd te worden, maar in de praktijk is er een wezenlijk verschil tussen deze twee typen van de scheikunde.Chemie in het algemeen
De chemie of scheikunde is een wetenschap die de bouw en de samenstelling van stoffen probeert te achterhalen. Meestal gaat het dan over chemische veranderingen. De chemie lijkt sterk op de fysica (natuurkunde), maar verschilt daarvan wel degelijk. Er bestaat wel een tak van wetenschap die de chemie en de fysica omvat: de fysische chemie.Nu blijven we echter bij de chemie. Alle stoffen bestaan uit atomen. Zij zijn erg klein en voortdurend in beweging. Atomen kunnen een chemische binding met elkaar aangaan tot grotere groepen die moleculen genoemd worden. Deze atomen en moleculen kunnen dus zeer veel verschillende stoffen vormen, waarbij ze constant muteren. Dit fenomeen wordt onderzocht bij de chemie, waarbij men ook probeert wetmatigheden uit de (meet)resultaten af te leiden.
Organische chemie
Organische chemie is de tak van de scheikunde die zich bezig houdt met de organische verbindingen, dat wil zeggen verbindingen waarin vrijwel altijd koolstofatomen voorkomen, vaak vergezeld door waterstofatomen. Ze wordt ook wel de koolstofchemie genoemd. Omdat deze verbindingen van oorsprong in levende organismen voorkomen, worden ze organisch genoemd. Veel mensen ervaren de organische chemie als ingewikkelder en talrijker dan de anorganische chemie, die hieronder behandeld wordt. Anorganische verbindingen kunnen in een enorm aantal vormen voorkomen, een groot deel van de verbindingen op aarde is dan ook organisch. Denk aan aardgas, aardolie en steenkool, maar bijvoorbeeld ook aan vetten en koolhydraten, onmisbaar voor je lichaam. De verbindingen zijn altijd als volgt opgebouwd: het skelet van de verbinding bestaat altijd uit koolstofatomen.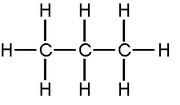
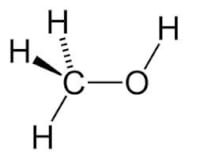
Anorganische chemie
De anorganische chemie is de andere tak van de scheikunde, die zich bezig houdt met anorganische chemische verbindingen. Dit zijn normaal gesproken verbindingen zonder koolstofatomen, zoals zouten, metalen en water. Maar ook verbindingen met koolstofatomen kunnen anorganisch zijn, denk hierbij aan koolstofdioxide. Over het algemeen zijn anorganische verbindingen eenvoudiger opgebouwd dan organische verbindingen en bestaan ze uit minder atomen.Een zeer bekend onderdeel van de anorganische chemie zijn de zouten. En dan bedoelen we niet de stof keukenzout, maar een zout is een stof bestaande uit een metaalatoom en een niet-metaal atoom (bijvoorbeeld soda: Na2CO3). Hierbij vormen de verschillende stoffen ionen, dit zijn geladen deeltjes, die door magnetische kracht samen een zout vormen. Zouten zijn meestal oplosbaar in water, ze geleiden dan elektrische stroom (doordat ze in water uiteenvallen in de eerder genoemde ionen), maar dit hoeft niet altijd het geval te zijn.
Een ander onderdeel van de anorganische chemie zijn de metalen. Metalen zijn stoffen, bestaande uit grote groepen samengeklonterde metaalatomen (ijzer, aluminium, koper) waarbij losse elektronen, afkomstig uit van de metaalatomen, tussen de atomen doorzweven. Hierdoor geleidt een metaal altijd elektrische stroom en is het metaal zeer sterk. In metalen komen helemaal geen koolstofatomen voor.
Enkele voorbeelden van anorganische chemische processen in het dagelijks leven: