Waterstof: Het element
 Waterstof is een chemisch element met symbool H en atoomnummer 1. Met een atoomgewicht van 1,00794 u, is waterstof het lichtste en tevens meest voorkomende element in het universum. 75 procent van alle ons bekende materie in het universum is waterstof. De meest voorkomende isotoop van waterstof (1H), heeft een proton en geen neutron. Een negatief waterstof ion (-H) is een "kale" proton.
Waterstof is een chemisch element met symbool H en atoomnummer 1. Met een atoomgewicht van 1,00794 u, is waterstof het lichtste en tevens meest voorkomende element in het universum. 75 procent van alle ons bekende materie in het universum is waterstof. De meest voorkomende isotoop van waterstof (1H), heeft een proton en geen neutron. Een negatief waterstof ion (-H) is een "kale" proton. Periodiek systeem. Waterstof atoomnummer 1. / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
Periodiek systeem. Waterstof atoomnummer 1. / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)Plaats in het periodiek systeem van het element waterstof
Het element waterstof is ontstaan tijdens de recombinatie(240000-300000 jaar na de oerknal) tijdperk. Bij standaard temperatuur en druk, is waterstof een kleurloos, reukloos, smaakloos, niet-toxisch, zeer brandbaar diatomische gas met als molecuulformule H2. Waterstof vormt gemakkelijk (covalente) verbindingen met de meeste niet-metalen. De meeste waterstof op aarde bestaat in moleculaire vorm of in verbindingen zoals water H20. Waterstof kan verbindingen met de meeste elementen vormen en is aanwezig in water en organische verbindingen. Het speelt een belangrijke rol in de (zuur-base) chemie.Algemene eigenschappen van het element waterstof
| Naam | Symbool | Atoom- nummer | Groep | Periode | Blok | Reeks | Kleur | Atoom- massa(u) |
|---|---|---|---|---|---|---|---|---|
| Waterstof - hydrogen | H | 1 | 1 | 1 | s | Diatomic niet-metaal (ook als metalloid beschouwd) | Kleurloos | 1,008 (1) |
Chemische eigenschappen van het element waterstof
| Elektronen- configuratie | oxidatie- toestanden | Elektro- negativiteit (pauling) | Atoom- straal (pm) | ionisatie- potentiaal (KJ/mol) | Aggregatie- toestand 20C | Magnetisme |
|---|---|---|---|---|---|---|
| 1s1 schil 1 | 1,-1 (amphoteric oxide) | 2,20 | Covalent radius 31+/-5 van der Waals radius 120 | 1ste 1312,0 | gas | Dia- magnetisch |
Fysische eigenschappen van het element waterstof
| Dichtheid | Smeltpunt- kookpunt | smeltwarmte verdampings- warmte (KJ/mol) | Kristal- structuur | Warmte- geleiding (W/m.K) | Triplepunt | Kritische punt |
|---|---|---|---|---|---|---|
| 0,0899 g/L(bij oC en 101,375 KPa) 0,07g/cm3 vast bij smeltpunt | smeltpunt: 13,99 K kookpunt: 20,271 K | (H2) 0,117 (H2) 0,904 | Hexa- gonaal | 0,1805 | 13,8033 K (7,041 kPa) | 32,938 K (1,2858 MPa) |
Stabielste isotopen van waterstof
| Isotoop | NA(%) | Halveringstijd | Verval via | Vervalenergie(MeV) | Vervalproducten |
|---|---|---|---|---|---|
| 1H Protium | 99.9885% | 1H is stabiel met 0 neutronen | [/TD][TD] | [/TD] | |
| 0.0115% | 2H stabiel met 1 neutron | [/TD][TD] | [/TD] | ||
| sporen | 12,32 jaar | β− | 0.01861 | 3He |
Isotopen van het element waterstof
Waterstof heeft drie natuurlijk voorkomende isotopen: 1H, 2H en 3H.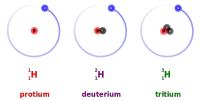 De 3 isotopen van waterstof,1H,2H en 3H / Bron: Dirk H?nniger / Erwin85, Wikimedia Commons (CC BY-SA-3.0)
De 3 isotopen van waterstof,1H,2H en 3H / Bron: Dirk H?nniger / Erwin85, Wikimedia Commons (CC BY-SA-3.0)Protium (1H), de meest voorkomende isotoop van waterstof, heeft één proton en één elektron en geen neutronen. Het aandeel 1H is 99,98% van alle waterstof.
Deuterium (Zwaar water)
Deuterium (2H) is een stabiele isotoop van waterstof, bestaat uit een proton en een neutron in zijn kern. Alle deuterium in het heelal is ontstaan tijdens de Big Bang. Deuterium is niet radioactief. Water met moleculen die deuterium in plaats van normaal waterstof bevatten heet zwaar water. Zwaar water wordt gebruikt als neutron moderator en als koelmiddel in kernreactoren. Deuterium is een potentiële brandstof bij eventuele toekomstige kernfusie.
Tritium
Tritium (3H) bevat één proton en twee neutronen in de kern. Het is radioactief, vervalt tot helium-3 door beta verval met een halfwaardetijd van 12,32 jaar. Het is zo radioactief dat het wordt gebruikt in lichtgevende verf en in horloges. Het glas voorkomt lekage van stralen. Kleine hoeveelheden tritium komt voor in de natuur door de interactie van kosmische straling met atmosferische gassen. Tritium komt vrij bij kernproeven. Het wordt gebruikt in kernfusie reacties en als verlichting in zelf-aangedreven apparaten. Tritium wordt gebruikt aks radiolabel, dat is een radioactieve stof die ingebracht wordt om een proces te volgen.
Historie van waterstof
- De naam van waterstof (van Grieks hydro = "water" en-genen = "schepper")
- The Döbereiner's lamp en limelight (kalklicht) zijn uitgevonden in 1823.
- Waterstof werd voor het eerst vloeibaar gemaakt door James Dewar in 1898, een jaar later produceerde hij vaste waterstof.
- Deuterium werd ontdekt in december 1931 door Harold Urey,
- Trtitium werd in 1934 opgesteld door Ernest Rutherford, Mark Oliphant, en Paul Harteck.
- Zwaar water, bestaande uit deuterium in plaats van gewone waterstof werd ontdekt door Harold Urey en zijn team in 1932.
Voorkomen en productie van waterstof
Industrieel toegepaste waterstof is voornamelijk afkomstig uit aardgas, minder vaak uit energie-intensieve productie zoals de elektrolyse van water. Grote hoeveelheden waterstof spelen een rol bij verwerking van fossiele brandstof en in de ammoniak productie.De proton-protoncyclus
Atomaire waterstof H, is het meest voorkomende element in het universum. Uit wolken van moluculair waterstof H2 worden sterren gevormd. Waterstof voedt sterren met materie en energie door de proton-proton reactie (een kernfusiereactie waarbij 4 waterstofkernen (protonen) omgezet worden in 1 helium-4-kern.
H2 waterstofgas is zeer zeldzaam in de atmosfeer van de Aarde omdat het door het lichtgewicht gas gemakkelijk ontsnapt aan de aardse zwaartekracht. Toch is waterstof de derde meest voorkomende element op aarde, maar dan in de vorm van verbindingen zoals koolwaterstoffen en uiteraard water.
Laboratoriumproductiewaterstof H2
In het laboratorium wordt H2 gewoonlijk bereid door de reactie van verdund niet oxiderende zuren met sommige reactieve metalen als zink of aluminium:
- Zn + 2 H + → Zn2 + + H2
- 2 Al + 6 H2O + 2 OH- → 2 Al (OH) -4 + 3 H2
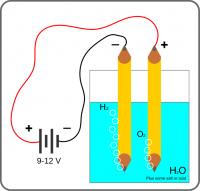 Zuurstof en waterstof productie door elektrolyse van water / Bron: Nevit Dilmen, Wikimedia Commons (CC BY-SA-3.0)
Zuurstof en waterstof productie door elektrolyse van water / Bron: Nevit Dilmen, Wikimedia Commons (CC BY-SA-3.0)De elektrolyse van water is een eenvoudige methode van waterstofproductie. Zuurstof wordt gevormd aan de anode en waterstof aan de kathode:
2 H2O(l)+ energie → 2 H2(g) + O2(g)
De toegevoegde energie komt weer vrij als we waterstof weer verbranden tot water. De energie van zonnecellen en windmolens wordt dus opgeslagen in waterstofvoorraad. Zonne- en windenergie "tanken" als we het nodig hebben. Er kunnen grote mobiele "batterijen" gebouwd worden.
Stoomreforming
Momenteel is een economisch belangrijke waterstofproductie het onttrekken van waterstof uit koolwaterstoffen, gewoonlijk geproduceerd door stoomreforming van gas. Bij hoge temperaturen (700-1100 ° C), reageert stoom met methaan tot koolmonoxide en H2:
- CH4 + H2O → CO + 3 H2
Andere belangrijke methoden voor H2 productie:
- 2 CH4 + O2 → 2 CO + 4 H2
Thermochemische waterstofwinning
Er zijn vele thermochemische cycli die kunnen worden gebruikt voor het splitsen van water, diverse van deze cycli worden getest om waterstof en zuurstof uit water te halen, zonder elektriciteit maar met zonne-energie.
Anaerobic corrosion
De anaerobe corrosie van ijzer leidt eerst tot vorming van ferro-hydroxide en wordt beschreven door de reactie:
- Fe + 2 H2O → Fe (OH) 2 + H2
Onder anaerobe omstandigheden kan ferrohydroxide (Fe(OH)2) worden geoxideerd door water tot magnetiet(Fe3O4) en moleculaire hydrogen (H2):
- 3 Fe (OH) 2 + 2 H2O → Fe3O4 + H2; (ferrohydroxide → magnetiet + water + Hydrogen)
De gekristalliseerde magnetiet (Fe3O4) is thermodynamisch stabieler dan de ferrohydroxide (Fe(OH)2). Dit proces treedt op tijdens anaerobe corrosie van ijzer in zuurstofarme (grond)water.
Kenmerkende eigenschappen van waterstof
WaterstofbrosheidWaterstof is een probleem in de metallurgie, het lost gemakkelijk op in metaal en maakt het metaal bros (waterstofbrosheid).
Knalgas
Waterstofgas vormt ontplofbare mengsels met lucht. Het mengsel wordt ontstoken door een vonk, hitte of zonlicht. De waterstof temperatuur van spontane ontbranding in de lucht is circa 500 ° C. Zuivere waterstof-zuurstof vlammen geven ultraviolet licht af, bij een hoog zuurstof gehalte een bijna met het blote oog onzichtbaar licht. De waterstofvlam kan onder andere omstandigheden blauw zijn en lijkt op de blauwe aardgasvlam.
Waterstofhalogeniden
H2 reageert met elk oxiderend element. Het kan spontaan reageren, bij kamertemperatuur, met chloor en fluor en vormt waterstofhalogeniden, waterstofchloride en waterstoffluoride, die gevaarlijk zuren vormen.
Elektron energie niveaus
De grondtoestand energieniveau van het elektron in een waterstofatoom -13,6 eV, wat overeenkomt met een ultraviolet foton van ongeveer 92 nm. De energieniveaus van waterstof atoom kunnen vrij nauwkeurig worden berekend met het klassieke Bohr atoommodel, waarin het elektron als "baan" rond het proton cirkelt. Met de elektromagnetische kracht trekt elektron en proton elkaar aan. Het elektron in het Bohrmodel kan alleen op bepaalde toegestane afstanden van het proton cirkelen en dus slechts bepaalde toegestane energieën hebben.
Covalente en organische verbindingen
H2 gaat verbindingen aan met veel elementen. Waterstof kan verbindingen met elementen die meer elektronegatief zijn, zoals halogenen F, Cl, Br, I of zuurstof; in deze verbindingen neemt waterstof ion een positieve lading aan. Waterstof vormt tevens verbindingen met minder elektronegatieve elementen, zoals metalen en metalloïden. Deze verbindingen worden hydriden genoemd.
Koolwaterstoffen
Waterstof vormt een breed scala van verbindingen met koolstof, genaamd koolwaterstoffen, en een nog groter aantal verbindingen met andere atomen dan koolstof. Vanwege hun associatie met levende wezens, organische verbindingen genoemd. De studie van hun eigenschappen heet organische chemie en studie van levende organismen heet biochemie. De koolstof-waterstof binding geeft deze koolwaterstoffen bepaalde chemische eigenschappen.
Hydriden
Verbindingen met waterstof vaak hydriden genoemd. De term "hydride" suggereert dat het H-atoom een negatieve karakter heeft verkregen, aangeduid H- en wordt gebruikt wanneer waterstof een verbinding vormt met een elektropositief element. Hydriden worden gevormd met bijna alle belangrijke elementen uit het periodiek systeem, het aantal en de combinatie van mogelijke verbindingen varieert sterk; bijvoorbeeld, zijn er meer dan 100 binaire boraanhydriden, maar slechts één binaire aluminiumhydride.
Toepassingen van Waterstof
- Grote hoeveelheden H2 nodig in de aardolie- en chemische industrie. De grootste toepassing van H2 is bij de verwerking van fossiele brandstoffen en de productie van ammoniak.
- De belangrijkste afnemers van H2 in de petrochemische fabriek houden zich bezig met hydrodealkylatie, ontzwaveling en waterstof kraken. H2 heeft een aantal andere toepassingen: het wordt gebruikt bij de productie van onverzadigde vetten en oliën (bijvoorbeeld margarine), en in de productie van methanol. Waterstof is onmisbaar in de productie van zoutzuur.H2 wordt ook gebruikt als een reductiemiddel van ertsen.
- Waterstof is zeer oplosbaar in zeldzame aarde en overgangsmetalen en is oplosbaar in zowel kristallijne en amorfe metalen. Oplosbaarheid waterstof in metalen beïnvloed door plaatselijke vervormingen of onzuiverheden in het kristal rooster. De oplosbaarheid van het gas is een metallurgisch probleem, vanwege de waterstofbrosheid van metalen.
- Naast het gebruik als reagens, H2 heeft brede toepassing in natuurkunde en techniek. Het wordt gebruikt als beschermgas in lastechnieken, als atomair waterstof lassen. H2 wordt gebruikt als de rotor koelmiddel in elektrische generatoren in elektriciteitscentrales, omdat het de hoogste thermische geleidbaarheid van elk gas heeft. Vloeibaar H2 wordt gebruikt in cryogene onderzoek, inclusief studies naar supergeleiding. Omdat H2 is lichter dan lucht, met iets meer dan 1/14 van de dichtheid van de lucht, is het gebruikt als een lifting gas in ballonnen en luchtschepen.
- In meer recente toepassingen, wordt waterstof puur of gemengd met stikstof gebruikt als indicatorgas voor lekdetectie van leidingen en vaten.
- Waterstof's zeldzamere isotopen ook hebben elk specifieke toepassingen. Deuterium (waterstof-2) wordt gebruikt in toepassingen nucleaire splitsing als moderator om neutronen te vertragen, en in kernfusie reacties. Deuterium verbindingen hebben toepassingen in de chemie en de biologie in de studies van de reactie isotoop-effecten. Tritium (waterstof-3), geproduceerd in kernreactoren wordt gebruikt bij de productie van de waterstofbom, een isotopisch label in de biowetenschappen en als stralingsbron in lichtgevende verf.
- Het eerste waterstof gekoeld turbogenerator ging brengen met gasvormig waterstof als koelmiddel in de rotor en de stator in 1937 in Dayton.
Koelmiddel
Waterstof wordt vaak gebruikt in krachtcentrales als koelmiddel in generatoren, wegens gunstige eigenschappen die gevolg van het lichte atoom zijn. Deze omvatten lage dichtheid, lage viscositeit en de hoge specifieke warmtegeleiding.
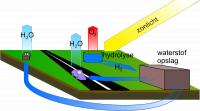 Duurzame waterstof eonomie / Bron: Silver Spoon Sokpop, Wikimedia Commons (CC0)
Duurzame waterstof eonomie / Bron: Silver Spoon Sokpop, Wikimedia Commons (CC0)Energie uit zonne-, wind-, biologische- of elektrische bronnen kan opgeslagen worden in waterstof, waterstof als energiedrager. De energie komt op aanvraag vrij door de waterstof- zuurstof reactie, waarbij de tijdens elektrolyse geïnvesteerde energie weer vrijkomt op elk gewenst moment:
- 2 H2(g) + O2(g) → 2 H2O(l) + 572 kJ + (286 kJ/mol)
Nikkelwaterstof Batterij
De Ni-MH batterij is voor het eerst in 1977 gebruikt aan boord van de Amerikaanse satelliet (NTS-2). De ISS Mars Odyssey en de Mars Global Surveyor zijn ook uitgerust met Ni-MH batterij, evenals de Hubble Space Telescope NIH2. Een nikkel-waterstof-accu Ni-H2) is een oplaadbare elektrochemische energiebron op basis van nikkel en waterstof. De kathode bestaat uit een gesinterde poreuze nikkelplaat met nikkelhydroxide, de negatieve waterstof-elektrode is een platina katalysator, de scheidingswand is asbestpapier. NI-H2 cellen hebben een levensduur van meer dan 15 jaar. NIH2 oplaadbare batterijen zijn aantrekkelijk voor de opslag van elektrische energie in satellieten en ruimtesondes en in de toekomst voor energieopslag in het algemeen.
 Met waterstof gevulde luchtschip Hindenburg stort brandend neer, het heeft de ontwikkeling van de waterstof technologie enorm vertraagd / Bron: Sam Shere, Wikimedia Commons (Flickr Commons)
Met waterstof gevulde luchtschip Hindenburg stort brandend neer, het heeft de ontwikkeling van de waterstof technologie enorm vertraagd / Bron: Sam Shere, Wikimedia Commons (Flickr Commons)De eerste waterstof gevulde ballon werd uitgevonden door Jacques Charles in 1783. Ferdinand von Zeppelin bevorderde het idee van luchtschepen gelift door waterstof (Zeppelins); de eerste vlucht was in 1900. Ze hebben zonder een ernstig incident 35.000 passagiers vervoerd tot 1914.
Passagiersdienst wordt hervat in de jaren 1920. De ontdekking van helium reserves in de VS betekende nog meer veiligheid. De Amerikaanse regering weigerde om het gas te verkopen voor dit doel. Daarom werd H2 gebruikt in de Hindenburg, die in 1937 neerstortte in een vuurzee in New Jersey. Er kwamen van de 97 opvarenden 36 om het leven. De oorzaak is nog steeds niet duidelijk. Het vertrouwen in waterstof is door dit ongeluk verdwenen.