Vervalreacties opstellen - theorie en voorbeelden
 Isotopen zijn elementen met een verschillende hoeveelheid neutronen in de kern, waardoor deze instabiel raken. Deze instabiliteit raken isotopen kwijt na verloop van tijd door verval. Dit verval kan zeer kort zijn, maar ook miljarden jaren duren, afhankelijk van welk isotoop vervalt. Bij verval kunnen bepaalde deeltjes vrijkomen, maar hoe wordt dit uitgedrukt in een reactievergelijking, en wat voor soorten verval bestaan er in een isotoop?
Isotopen zijn elementen met een verschillende hoeveelheid neutronen in de kern, waardoor deze instabiel raken. Deze instabiliteit raken isotopen kwijt na verloop van tijd door verval. Dit verval kan zeer kort zijn, maar ook miljarden jaren duren, afhankelijk van welk isotoop vervalt. Bij verval kunnen bepaalde deeltjes vrijkomen, maar hoe wordt dit uitgedrukt in een reactievergelijking, en wat voor soorten verval bestaan er in een isotoop?Isotopen - vervaardiging
Isotopen worden vervaardigd door met een bepaald apparaat, dikwijls een deeltjesversneller of een kanon, protonen of neutronen af te vuren op een atoom. Dit atoom neemt dan het deeltje, door de grote hoeveelheid energie waarmee het in aanraking komt, op in haar kern waardoor de eigenschappen zoals het atoomnummer (de hoeveelheid protonen in een kern) en de atoommassa (de massa van de protonen en neutronen bij elkaar opgeteld) veranderen. Nadat het atoom een deeltje heeft opgenomen is het afhankelijk van het opgenomen deeltje en het atoom welk soort verval hierbij optreedt. Er zijn vier verschillende soorten verval waarbij het atoom significant verandert: Figuur 1: Algemene reactie voor α-verval
Figuur 1: Algemene reactie voor α-vervalα-verval
Indien men spreekt van α-verval, dan vervalt een atoom in een dochterkern, ook wel het vervalproduct genoemd, en een zogeheten α-deeltje, ook wel een heliumkern genoemd. Dit is de minst gevaarlijke vorm van verval omdat de heliumkernen relatief groot zijn: ze worden gestopt na enkele centimeters lucht of een vel papier. Toch blijft deze vorm van straling gevaarlijk vanwege het feit dat de uitgezonden heliumkernen reacties aan kunnen gaan met weefsel, waardoor vergiftiging kan optreden. Omdat een heliumkern bestaat uit twee protonen en twee neutronen zal het massagetal met 4 afnemen en het atoomgetal met 2. Een algemene notatie voor deze vervalreactie is afgebeeld in figuur 1. Figuur 2: verval van Astaat-218
Figuur 2: verval van Astaat-218Astaat-218 heeft een halveringstijd van 2 seconden. Het type verval van Astaat-218 is α-verval. Noteer de vervalreactie.
In de vraag staat aangegeven dat het type verval α-verval is, waardoor duidelijk wordt dat een heliumkern wordt uitgezonden. In figuur 2 staat de vervalreactie aangegeven van astaat-218. Hierbij is de dochterkern, het vervalproduct, bismut-214, wat via twee manieren kan vervallen: α-verval of β-minverval.
 Figuur 3: Algemene reactie voor β-minverval
Figuur 3: Algemene reactie voor β-minvervalβ-minverval
Bij β-minverval vervalt een neutron in de moederkern tot een proton en een elektron (en zeer strikt genomen, een anti-elektronneutrino ter behoud van het elektron-leptongetal.). Omdat bij deze vervalreacties een elektron wordt uitgezonden in plaats van een heliumkern, is de penetratie van dit soort straling iets beter. Bij β-minverval is een plaat van licht materiaal, zoals aluminium of een polymeer, voldoende om het elektron te stoppen. Een algemene notatie voor een β-minvervalreactie is afgebeeld in figuur 3. Het is bij een dergelijke reactie niet verplicht om het anti-elektronneutrino (of andere dergelijke leptonen) te vermelden, maar voor de volledigheid van de vervalreacties worden deze wel vermeld.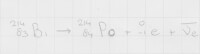 Figuur 4: verval van Bismut-214
Figuur 4: verval van Bismut-214In het vorige voorbeeld is het verval van astaat-218 aangehaald. De dochterkern van die vervalreactie kan vervallen door middel van β-minstraling. Oftewel, in de kern van bismut-214 kan een neutron vervallen tot een proton en een elektron, waarbij een elektron en een anti-elektronneutrino worden uitgestoten. In figuur 4 is deze reactie afgebeeld. Opeenvolgende vervalreacties van dochterkernen worden vervalreeksen genoemd en laten het vervaltraject zien van een isotoop, tot deze stabiel wordt en niet meer vervalt. Zoals in figuur 4 staat afgebeeld is het vervalproduct polonium-214, en die isotoop vervalt weer via α-straling tot een isotoop van lood enzovoorts.
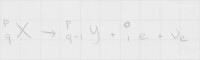 Figuur 5: Algemene reactie voor β-plusverval
Figuur 5: Algemene reactie voor β-plusvervalβ-plusverval
β-plusverval is een soort verval dat niet spontaan kan plaatsvinden. Bij β-plusverval vervalt een proton namelijk in een neutron (een neutron heeft meer massa dan een proton, dus er moet energie worden geïnvesteerd) en een positron (en een elektronneutrino). De eigenschappen van het uitgezonden deeltje, het positron, zijn, afgezien van de lading, gelijk aan die van een elektron: beide deeltjes hebben dezelfde massa en worden tegengehouden door dezelfde materialen. In figuur 5 staat een algemene vervalreactie van β-plusverval, waarbij de energie niet wordt aangegeven.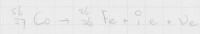 Figuur 6: Verval van Kobalt-56
Figuur 6: Verval van Kobalt-56Een isotoop die via β-plusverval vervalt is kobalt-56. Bij dit verval komen een positron en een elektronneutrino vrij, zoals aangegeven in figuur 6. Dit verval levert de zeer stabiele isotoop ijzer-56 op.
 Figuur 7: verval van Chroom-51
Figuur 7: verval van Chroom-51