IJzer: Het element
 IJzer is qua massa het meest voorkomende element op aarde, het komt overvloedig voor in het binnenste van de aarde en het is het vierde meest voorkomende element in de aardkorst. De ijzer overvloed wordt veroorzaakt door de fusie in zware sterren, waar de productie van nikkel-56 de laatste exotherme kernfusie reactie is, voordat de ster instort(supernova). IJzer is het verval product van het nikkel en wordt tijdens de ineenstorting van de supernova weggeblazen in de ruimte.
IJzer is qua massa het meest voorkomende element op aarde, het komt overvloedig voor in het binnenste van de aarde en het is het vierde meest voorkomende element in de aardkorst. De ijzer overvloed wordt veroorzaakt door de fusie in zware sterren, waar de productie van nikkel-56 de laatste exotherme kernfusie reactie is, voordat de ster instort(supernova). IJzer is het verval product van het nikkel en wordt tijdens de ineenstorting van de supernova weggeblazen in de ruimte.
 Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)Plaats van het element ijzer in het periodiek systeem
IJzer is een scheikundig element met symbool Fe (Latijn: ferrum) en atoomnummer 26. Het is een overgangsmetaal en een element uit groep 16 in het periodiek systeem. IJzer heeft als element en chemische verbinding vele toepassingen. IJzer vormt binaire verbindingen met halogenen en chalcogens. Chalcogens ook oxygen family genoemd zijn de elementen oxygen (O), sulfur (S), selenium(Se), tellurium (Te). De verbindingen van de zware chalcogens ( sulfides, selenides, en tellurides) worden chalcogenides genoemd.Nucleosynthese de herkomst van het element ijzer
IJzer wordt gemaakt in zware, hete sterren volgens het volgende proces:- Een calciumkern fuseert met een helium kern en creëert onstabiel titanium.
- Het titanium fuseert met een andere helium kern, waardoor onstabiel chroom ontstaat.
- Het chroom fuseert met een helium kern en creëert onstabiel ijzer.
- Het ijzer fuseert met een ander helium kern en creëert instabiel nikkel-56.
- Vorming van nikkel-56 is de laatste exotherme reactie die weerstand biedt aan ineenstorting van de ster (supernova).
- Nikkel-56 vervalt tot onstabiel kobalt-56, die op zijn beurt vervalt tot stabiel ijzer-56 dat bij ineenstorting van de supernova in een explosie de ruimte in wordt geschoten.
Algemene eigenschappen van het element ijzer
| Naam | Symbool | Atoom- nummer | Groep | Periode | Blok | Reeks | Kleur |
|---|---|---|---|---|---|---|---|
| IJzer Ferrum | Fe | 26 | 8 | Periode 4 | D-blok | Overgangs- metaal | Metallisch wit/grijs |
Chemische eigenschappen van het element ijzer
| Atoom- massa (u) | Elektronen- configuratie | Oxidatie- toestanden | Elektro- negativiteit (Pauling) | Atoom- straal (pm) | Ionisatie- potentiaal (KJ/mol | Aggre- gatie- toestand (20 C) |
|---|---|---|---|---|---|---|
| 55.845(2) | [Ar] 3d6 4s2 Per schil: 2, 8, 14, 2 | 6, 5, 4, 3, 2, 1, −1, −2 (amphoteric oxide) | 1.83 | Empirisch: 126 Covalente rad. Low spin: 132±3 High spin: 152±6 | 1st: 762 2nd: 1561. 3rd: 2957 | vast |
Fysische eigenschappen van het element ijzer
| Dicht- heid ( 0 °C) (g/cm3) | Smelt- punt (K) | Kook- punt (K) | Smelt- warmte (KJ/mol) | Verdamp- ings- warmte (KJ/mol) | Kristalstructuur | Warmte- geleiding (W/m.K) | Elek- trische weer- stand (nΩ.m) | Magnet- isme |
|---|---|---|---|---|---|---|---|---|
| 7.874 | 1811 K 1538 °C 2800 °F | 3134 K 2862 °C 5182 °F | 13,81 | 340 | Kubisch ruimtelijk centreerd (KRC) Kubisch vlakken centreerd (KVC) | 80,4 | 96.1 (20 °C) | Ferro magnetisme |
Het Curiepunt
Op 770 ° C (Curie-punt, Tc) wordt ijzer magnetisch. IJzer passeert de Curie temperatuur zonder verandering in de kristallijne structuur, wel treedt verandering op in de "domeinstructuur", met name in de elektronen spin. In niet magnetisch ijzer, staan alle elektronen spins van de atomen binnen een domein in dezelfde richting, maar de aangrenzende domeinen wijzen in verschillende richtingen en dus heffende spins elkaar op. In gemagnetiseerd ijzer worden de elektronen spins van alle domeinen gelijk gericht, zodat het magnetische effect van alle domeinen elkaar versterken en het stuk ijzer is magnetisch.Mechanische eigenschappen van het element ijzer
| Elasticiteits- modules (GPa) | Trek- vastheid GPa | Afschuif modules (GPa) | Bulk modules (GPa) | Poisson factor | Hardheid | Thermal expansion µm/m.K (25 °C) |
|---|---|---|---|---|---|---|
| 211 | --- | 82 | 170 | 0,29 | Mohs 4 Vickers 608 MPa Brinell 490 MPa | 11,8 |
Isotopen van het element ijzer
Natuurlijk voorkomende ijzer bestaat uit vier stabiele isotopen: 5,845% van 54Fe, 91,754% van 56Fe, 2,119% van 57Fe en 0,282% van 58Fe.60Fe is een uitgestorven radionuclide met halfwaardetijd (2,6 miljoen jaar), zijn uiteindelijke verval product is stabiel nikkel-60.
De meest voorkomende ijzer isotoop 56Fe is van belang voor wetenschappers omdat het eindpunt van de vorgenoemde nucleosynthese is. 56Ni wordt geproduceerd uit lichtere kernen in het alpha-proces in kernreacties in massieve sterren (supernovae), nikkel-56 is het eindpunt van de fusie keten binnen deze zware sterren. Deze nikkel-56, met halfwaardetijd van 6 dagen, is gemaakt in deze sterren, maar vervalt door twee positron (beta+) emissie in vervalproducten in de supernova wolk, eerst in radioactieve kobalt-56 en vervolgens in stabiele ijzer-56.
IJzer-56 is een van de zwaarste stabiele isotopen geproduceerd in het alfa proces in stellaire nucleosynthese; elementen zwaarder dan ijzer en nikkel vereisen een supernova voor hun vorming. IJzer-56 is de meest voorkomende metaal in ijzermeteorieten en in de kernen van planeten zoals de aarde.
De stabielste isotopen van het element ijzer
| Isotoop | NA(%) | Halveringstijd | Verval via | Vervalenergie(MeV) | Verval producten |
|---|---|---|---|---|---|
| 54Fe | 5,8% | 3,1x10↑22 jaar | Beta+beta+ | 0,68 | 54Cr |
| 55Fe | synthetisch | 2,73 jaar | epsilon | 0,231 | 55Mn |
| 56Fe | 91,72% | Is stabiel met 30 neutronen | --- | --- | --- |
| 57Fe | 2,2% | Is stabiel met 31 neutronen | --- | --- | --- |
| 58Fe | 0,28% | Is stabiel met 32 neutronen | --- | --- | --- |
| 59Fe | synthetisch | 44,50 dagen | beta- | 1,565 | 59Co |
| 60Fe | Synthetisch | 2,6x10↑6 jaar | beta- | 3,978 | 60Co |
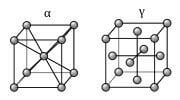 Links kubisch ruimtelijk centreerd (KRC)- en rechts kubisch vlakken centreerd (KVC) kristalstructuur / Bron: Alu, Wikimedia Commons (CC BY-SA-3.0)
Links kubisch ruimtelijk centreerd (KRC)- en rechts kubisch vlakken centreerd (KVC) kristalstructuur / Bron: Alu, Wikimedia Commons (CC BY-SA-3.0)Allotropen van het element ijzer
IJzer is een voorbeeld van allotropy in een metaal. Er zijn vier allotrope vormen(atoomstapelingen) van ijzer, namelijk alfa α, gamma γ, delta δ en epsilon ε.Als gesmolten ijzer afkoelt kristalliseert bij 1538 ° C in zijn delta δ allotroop, die heeft een kubisch ruimtelijke gecenterd (KRC) kristalstructuur. Verdere afkoeling tot 1394 ° C, verandert de structuur in gamma γ ijzer dat is een kubisch vlakken gecenterd kristalstructuur (KVC) van austeniet. Bij 912 ° C en lager wordt de kristalstructuur weer de kubisch ruimtelijk gecenterd (KRC), de alfa structuur van ferriet.
Alfa- en gamma ijzer
Kennis van de eigenschappen van de allotropen van ijzer is essentieel voor het begrijpen van de mechanische eigenschappen van staal en dus voor de vervaardiging van staal.α-ijzer (ferriet), is de meest stabiele vorm van ijzer bij normale temperatuur. Het is een tamelijk zachte toestand dat slechts een kleine concentratie van koolstof (niet meer dan 0,02 gewichts% bij 910 ° C) kan oplossen.
Boven 912 ° C tot 1400 ° C α-ijzer(ferriet) ondergaat een faseovergang van KRC naar de KVC structuur van γ-ijzer (austeniet). Dit is eveneens zacht metaal (gebied van warm deformatie zoals smeden) maar er kan aanzienlijk meer koolstof oplossen (2,04% bij 1146 ° C) waardoor de mechanische eigenschappen van het eindproduct, afhankelijk van het koolstof gehalte, liggen tussen hard en zacht, bros en taai; sterk en zwak.
 IJzererts magnetiet / Bron: Ryan Somma, Wikimedia Commons (CC BY-SA-2.0)
IJzererts magnetiet / Bron: Ryan Somma, Wikimedia Commons (CC BY-SA-2.0) IJzererts hematiet / Bron: Rob Lavinsky / iRocks.com, Wikimedia Commons (CC BY-SA-3.0)
IJzererts hematiet / Bron: Rob Lavinsky / iRocks.com, Wikimedia Commons (CC BY-SA-3.0)Het voorkomen van ijzer
Metallisch ijzer wordt niet gevonden aan het aardse oppervlak, omdat het element ijzer een sterke neiging tot oxideren heeft, deze oxiden vormen de belangrijkste ertsen. Meeste ijzer in de aardkorst wordt gecombineerd met zuurstof in mineralen zoals hematiet (Fe2O3) en magnetiet (Fe3O4).Wereld voorraad aan ijzer in gebruik is circa 2200 kg per hoofd bevolking. hiervan is in meer ontwikkelde landen gemiddeld circa 10.000 kg per hoofd bevolking) in minder-ontwikkelde landen circa 2000 kg per hoofd bevolking.
 Hoogoven voor de vervaardiging van ruwijzer uit ijzerertsen
Hoogoven voor de vervaardiging van ruwijzer uit ijzerertsen1.Hete lucht aanvoer
2.Smeltzone
3.Vermindering gebied van ijzeroxide
4.Vermindering gebied van ijzeroxide
5.Voor verwarm zone
6.Aanvoer erts, kalksteen, cokes
7.Uitlaatgassen
8.Kolom van ijzererts, cokes en kalksteen
9.Verwijderen van slak
10. Aftappen vloeibaar ijzer
11.Verzamelen van rookgassen
/ Bron: Robert Blazek, Pezinok, Slovakia, Wikimedia Commons (Publiek domein)
Productie van het element ijzer
Industrieel productie van ijzer begint met ijzererts, voornamelijk hematiet (Fe2O3), en magnetiet (Fe3O4). Deze ertsen worden gereduceerd tot het metaal door behandeling met koolstof in de vorm van cokes. De omzetting wordt uitgevoerd in een hoogoven bij temperaturen van ongeveer 2000 ° C. De werkwijze bevat ook een kalksteen, die wordt gebruikt om siliciumhoudende mineralen in het erts te verwijderen. De cokes en kalksteen worden toegevoerd aan de bovenkant van de oven, ongeveer 4 ton per ton ijzer.De cokes reageert met zuurstof in de aangevoerde luchtstroom tot koolmonoxide:
- 2 C + O2 → 2 CO
- Fe2O3 + 3 CO → 2 Fe + 3 CO2
- CaCO3 → CaO + CO2
- CaO + SiO2 → CaSiO3
IJzerverbindingen
IJzer vormt verbindingen voornamelijk in de +2 en +3 oxidatie toestanden. IJzer(II)- en ijzer (III)verbindingen. IJzer komt ook in hogere oxidatietoestanden, waarvan een voorbeeld de paarse kaliumferraat (K2FeO4) dat ijzer in de +6 oxidatietoestand bevat. IJzer(IV) is een tussenproduct in vele biochemische oxidatiereacties. Talrijke organometallische verbindingen bevatten formele oxidatietoestanden van +1, 0, -1, -2. Er zijn ook gemengde valentie verbindingen die ijzer(II) en ijzer(111) bevatten, zoals magnetiet en Pruisisch blauw (FE4(Fe [GN]6)3). gebruikt als de traditionele "blue" in blauwdrukken. IJzeroxide / Bron: Publiek domein, Wikimedia Commons (PD)
IJzeroxide / Bron: Publiek domein, Wikimedia Commons (PD)Zoals andere groep 8 elementen, bestaat ijzer in meerdere oxidatietoestanden, -2 tot +6. de toestanden 2 en 3 zijn de meest voorkomende. Elementair ijzer komt voor in meteorieten en in andere zuurstofarme omgeving. Vers ijzeren oppervlak is glanzend zilvergrijs, maar oxideert in normale lucht tot gehydrateerd ijzeroxide, (roest) sommige metalen vormen een beschermende oxide laag, ijzeroxide echter zet uit en schilfert af, waardoor het onderliggende oppervlak weer verder roest. Tenslotte is het ijzer een bruine vlek in de aarde.
 IJzer(III)chloride (FeCl3) / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)
IJzer(III)chloride (FeCl3) / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)De ijzerverbindingen geproduceerd op de grootste schaal in de industrie zijn ijzer(II)sulfaat (FeSO4 • 7H2O) en ijzer(III)chloride (FeCl3). De eerste is een van de meest gemakkelijk beschikbare bronnen van ijzer(II), maar minder stabiel luchtoxidatie dan Mohr's zout ((NH4) 2Fe (SO4) 2 • 6H2O). IJzer(II) verbindingen worden in de lucht vaak geoxideerd tot ijzer(III) verbindingen.
Binaire ijzerverbindingen
IJzer reageert met zuurstof in de lucht te vormen verschillende oxide en hydroxide verbindingen; de meest voorkomende zijn ijzer (II, III) oxide (Fe3O4) en ijzer (III) oxide (Fe2O3). IJzer(II)oxide bestaat ook, maar is instabiel bij kamertemperatuur. Deze oxiden zijn de belangrijke ertsen voor de productie van ijzer. Ze worden ook gebruikt in de productie van ferrieten, magnetische opslagmedia in computers en pigmenten. De bekendste sulfide is ijzerpyriet (FeS2).De binaire ferro- en ferri halogeniden zijn bekend. De ferro halogeniden ontstaan meestal door de reactie van ijzer met de overeenkomstig binair halogeen zuur hetgeen leidt tot gehydrateerde zouten.
- Fe + 2 HX → FeX2 + H2 (X is de halogeen)
- 2 Fe + 3 X2 → 2 FeX3 (X = F, Cl, Br)
Verscheidene cyanide complexen zijn bekend. Het bekendste voorbeeld is Pruisisch blauw, (FE4 (Fe [GN] 6 3)). Kaliumferricyanide en kaliumferrocyanide zijn ook bekend. Pruisisch blauw wordt gebruikt als geneesmiddel tegen vergiftiging door thallium en radioactief cesium. Het is voorloper van het blauw in blauwdrukken, en werd gebruikt in een vroege vorm van fotografie, de cyanotypie. Opgelost inoxaalzuur dient Pruisisch blauw als inkt. Het wordt gebruikt in verf, in linten voor schrijfmachines en in carbonpapier. Het pigment is niet giftig en in de cosmetica gebruikt. Vanaf 1970 werd Pruisisch blauw steeds meer vervangen door phtaloblauw.
Ferrocene
Verschillende carbonylverbindingen van ijzer zijn bekend. De eerste ijzer (0) verbinding is ijzerpentacarbonyl, Fe (CO) 5, die wordt gebruikt om carbonyl ijzerpoeder, een zeer reactieve vorm van metallisch ijzer te produceren. Thermolyse van ijzerpentacarbonyl geeft de trinucleaire cluster, triiron dodecacarbonyl. Collman's reagens, Dinatriumtetracarbonylferraat, is een nuttig reagens voor organische chemie; bevat ijzer in de oxidatietoestand -2. Cyclopentadienyliron dicarbonyl dimeer bevat ijzer in de zeldzame +1 oxidatietoestand. Ferroceen is een zeer stabiel complex. De eerste sandwich verbinding bevat een ijzer (II) centrum met twee cyclopentadienyl liganden gebonden via alle tien koolstofatomen.Toepassingen van ijzer
IJzer en staal
Zuiver ijzer is zacht, het metaal wordt versterkt door bijmengselen in het bijzonder door koolstof. Bij een koolstof gehalte tussen 0,05% en 2,0%) spreken we van staal. Ruwijzer wordt in de hoogoven geproduceerd door ijzererts te reduceren met cokes(koolstof).Uit het ruwe ijzer dat een hoog koolstofgehalte heeft. Wordt in de staalfabriek door verdere desoxidatie, het koolstofgehalte op het gewenste percentage gebracht en eventueel andere legeringselementen toegevoegd.Ruw ijzer heeft 4-5% opgeloste koolstof en kleine hoeveelheden verontreinigingen zoals zwavel, magnesium, fosfor en mangaan. koolstof maakt het metaal hard en bros. Deze vorm van ijzer heet gietijzer.
Staal heeft maximaal 2% koolstof. In de staalfabriek wordt het koolstof verbrand, samen met andere onzuiverheden, met zuurstof. Andere metalen worden toegevoegd om staallegeringen naar wens van de klant te maken.
Biologische rol
IJzer speelt een belangrijke rol in de biologie, vormt complexen met moleculaire zuurstof tot hemoglobine en myoglobine. Deze verbindingen verzorgen eiwit / zuurstof transport in zoogdieren.IJzer is overvloedig aanwezig in de biologie. ijzer-eiwitten zijn te vinden in alle levende organismen. De kleur van bloed ontstaat door hemoglobine, een ijzer bevattend eiwit. De ijzer-zwavel clusters zijn alomtegenwoordig en omvatten nitrogenase, de enzymen die verantwoordelijk zijn voor de biologische stikstoffixatie.
Massa extinctie coefficient
IJzer wordt ook gebruikt voor bescherming tegen ioniserende straling, het is lichter en sterker dan beschermingsmateriaal als lood. Nadeel van ijzer is het roesten als het niet wordt beschermd door schilderen, galvaniseren, of een kunststof coating.De massa attenuatie coefficient is een maat voor hoe sterk een materiaal absorbeert of licht verstrooit per eenheid van massa. Massa attenuatie coefficients zijn ook gedefinieerd voor andere electromagnetische straling zoals X-stralen, voor geluid of andere afnemende straling. De massa attenuatie coefficient wordt ook massa absorptie coefficient genoemd of massa extinctie coefficient.
Bio-anorganische verbindingen
De meest bekende en bestudeerde "Bioanorganische" verbindingen van ijzer (ijzerverbindingen in de biologie) zijn de heemeiwitten: voorbeelden zijn hemoglobine, myoglobine en cytochroom P450. Deze verbindingen hebben te maken met transport van gassen, enzymen en gebruikt voor overbrengen van elektronen. Metaal proteïnen zijn een groep eiwitten met metaalion cofactoren. Voorbeelden van ijzer metalloproteïnen zijn ferritinand rubredoxin. Veel enzymen zijn belangrijk voor het leven zoals catalase en lipoxygenases.Diverse toepassingen van ijzer
- IJzerkatalysatoren worden gebruikt voor de productie van ammonia en de omzetting van koolmonoxide en koolwaterstoffen voor brandstoffen en smeermiddelen.
- IJzerpoeder in een zuur oplosmiddel werd gebruikt in de Bechamp vermindering vermindering nitrobenzeen tot aniline.
- IJzer (III) chloride vindt toepassing in water en behandeling van afvalwater, in het verven van doek als kleurstof in verven, in diervoeder, en als etsmiddel voor koper bij de vervaardiging van printplaten. De overige halogeniden zijn meestal beperkt tot laboratoriumtoepassingen.
- IJzer(II)sulfaat wordt gebruikt als een precursor voor andere ijzerverbindingen. Het wordt ook gebruikt voor reduceren van chromaat in cement. Het wordt gebruikt om levensmiddelen verrijkt en behandelen van ijzergebrek(anemie). IJzer(III) sulfaat wordt gebruikt bij het oplossen van minuut riolering deeltjes in de tank water. IJzer(II) chloride wordt gebruikt als een reducerende flocculatiemiddel in de vorming van ijzer complexen en magnetische ijzeroxiden, en als reductiemiddel in organische synthese.
Gezondheid en voeding
- Biologische beschikbaarheid: het aandeel van een voedingsstof in de bloedbaan en bereikt de cellen van de weefsels van organen van het lichaam.
- Voeding rijk aan ijzer is rood vlees, linzen, bonen, gevogelte, vis, bladgroenten, waterkers, kikkererwten, verrijkte ontbijtgranen.
- IJzer als voedingssupplementen is vaak ijzer(II)fumaraat, en ijzersulfaat.
- De geadviseerde dagelijkse hoeveelheid ijzer varieert, afhankelijk van leeftijd, geslacht en bron. Zuigelingen kunnen ijzersupplementen nodig hebben als ze met de fles gevoed worden.
- Bloed donoren en zwangere vrouwen lopen het risico van een te laag ijzergehalte en worden vaak geadviseerd om hun ijzerinname aan te vullen.
Opname en opslag van ijzer in het lichaam
- Iron overname vormt een probleem voor aërobe organismen, omdat ijzer slecht oplosbaar is in bijna neutrale pH. Zo hebben bacteriën geëvolueerd hoge affiniteit sequestreermiddelen (metaalbinders) waardoor deze hun eigenschappen verliezen. Na opname in cellen, ijzer opslag is zorgvuldig gereguleerd; vrije ijzerionen bestaan niet als zodanig. Een belangrijk onderdeel van deze regeling is het eiwit transferrine, die bindt ijzerionen geabsorbeerd uit de twaalfvingerige darm en draagt het in het bloed cellen.
- IJzeropname wordt gereguleerd door het lichaam dat geen fysiologische scheidingswijze kent. Slechts kleine hoeveelheden ijzer gaan dagelijks verloren door de huid, de controle van ijzer waarden moet dus door het reguleren van de inname plaatsvinden. Regulatie van ijzeropname vermindert bij sommige mensen als gevolg van een genetisch defect. In deze mensen, kunnen overmatige inname van ijzer leiden tot onder andere hemochromatose(Circa 0,5% van de blanken).
- MRI scans stellen vast dat ijzer zich ophoopt in de hippocampus van de hersenen van patiënten met de ziekte van Alzheimer en in de substantia nigra bij de ziekte van Parkinson.
- Bioremediatie (proces dat micro-organismen gebruiken om verontreinigd milieu terug te brengen tot oorspronkelijke staat ) IJzer-etende bacteriën leven in de rompen van gezonken schepen, zoals de Titanic. Deze acidofiele bacteriën oxideren ijzer.
Toxiteit van ijzer en ijzerverbindingen
Vrije elementaire ijzer reageert met peroxiden tot vrije radicalen, die reactief zijn en DNA, eiwitten en cellen beschadigen. Toxiciteit treedt op bij vrij ijzer in de cel. IJzer kan schade veroorzaken aan onder andere hart en lever, met nare gevolgen zoals coma, shock, leverfalen, zelfs de dood. 60 milligram ijzer per kilogram lichaamsgewicht wordt als dodelijk beschouwd.© 2014 - 2025 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
 Livermore: Het elementLivermorium is de synthetische superzware, niet in de natuur voorkomende, element met het symbool Lv en atoomnummer 116.…
Livermore: Het elementLivermorium is de synthetische superzware, niet in de natuur voorkomende, element met het symbool Lv en atoomnummer 116.…
 Lawrencium: Het elementLawrencium is een synthetisch chemisch element met een chemisch symbool Lr en atoomnummer 103. Het is een radioactief me…
Lawrencium: Het elementLawrencium is een synthetisch chemisch element met een chemisch symbool Lr en atoomnummer 103. Het is een radioactief me…
 Waterstof: Het elementWaterstof is een chemisch element met symbool H en atoomnummer 1. Met een atoomgewicht van 1,00794 u, is waterstof het l…
Waterstof: Het elementWaterstof is een chemisch element met symbool H en atoomnummer 1. Met een atoomgewicht van 1,00794 u, is waterstof het l…
 Chloroform in onze leefomgevingChloroform is een chemische stof die vooral bekend staat om zijn handige werking als anestheticum en zijn toepassingen b…
Chloroform in onze leefomgevingChloroform is een chemische stof die vooral bekend staat om zijn handige werking als anestheticum en zijn toepassingen b…
Gerelateerde artikelen
Bronnen en referenties
- http://www.jostchemical.com/tech_info/Chelates.pdf
- http://en.wikipedia.org/wiki/Iron
- http://news.nost.jp/2010/12/zeldzame-en-schaarse-metalen/ (Afbeelding: periodiek systeem)
- http://sciencenotes.org/?attachment_id=320(Ijzer embleem)
- http://www.geocities.ws/cesardemeester/materie1/materie1.html (afbeeldingen Atomium en ijzererts)
- Afbeelding bron 1: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 2: Alu, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 3: Ryan Somma, Wikimedia Commons (CC BY-SA-2.0)
- Afbeelding bron 4: Rob Lavinsky / iRocks.com, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 5: Robert Blazek, Pezinok, Slovakia, Wikimedia Commons (Publiek domein)
- Afbeelding bron 6: Publiek domein, Wikimedia Commons (PD)
- Afbeelding bron 7: Benjah bmm27, Wikimedia Commons (Publiek domein)
- Afbeelding bron 8: Ellywa, Wikimedia Commons (CC BY-SA-3.0)
Custor (173 artikelen)
Laatste update: 12-11-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 13
Laatste update: 12-11-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 13
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.