Eerste ordereacties toegelicht in Excel
 De snelheid van een chemische reactie kan sterk variëren. In een fractie van een seconde kunnen grote hoeveelheden stof reageren, maar het kan ook jaren duren voordat veranderingen meetbaar zijn. Dat alles is afhankelijk van de soort stof, de verdelingsgraad ervan, de concentraties, de temperatuur en de eventuele aanwezigheid van een katalysator. Het verband tussen reactiesnelheid en concentraties en het verloop van de reactiesnelheid gedurende de tijd kunnen in Excel-diagrammen zichtbaar worden gemaakt. Bij een eerste ordereactie is er een lineair verband tussen de reactiesnelheid en de molariteit van één stof. De werkbladen zijn te gebruiken ter verduidelijking, maar zijn ook geschikt voor het maken van verschillende grafieken in toetsen die gemaakt worden in Word.
De snelheid van een chemische reactie kan sterk variëren. In een fractie van een seconde kunnen grote hoeveelheden stof reageren, maar het kan ook jaren duren voordat veranderingen meetbaar zijn. Dat alles is afhankelijk van de soort stof, de verdelingsgraad ervan, de concentraties, de temperatuur en de eventuele aanwezigheid van een katalysator. Het verband tussen reactiesnelheid en concentraties en het verloop van de reactiesnelheid gedurende de tijd kunnen in Excel-diagrammen zichtbaar worden gemaakt. Bij een eerste ordereactie is er een lineair verband tussen de reactiesnelheid en de molariteit van één stof. De werkbladen zijn te gebruiken ter verduidelijking, maar zijn ook geschikt voor het maken van verschillende grafieken in toetsen die gemaakt worden in Word.- Chemische achtergrond
- Reactiesnelheid en concentratie
- Een eerste ordereactie, A → …
- Eerste ordereactie in Excel
- Het werkblad voor een eerste ordereactie
- De opmaak van het werkblad
- De grafieken invoegen
- Het gebruik van het werkblad
- Verandering beginconcentratie
- Gebruik katalysator
- Verandering van de reactieconstante
Chemische achtergrond
De reactiesnelheid wordt gedefinieerd als het aantal mol stof dat per liter per seconde wordt omgezet. Bij de reactie 2 A + B → 4 C wordt dit opgeschreven als: s = -½ Δ[A]/Δt = -Δ[B]/Δt = + ¼ Δ[C]/Δt.Door het plaatsen van de breuken (1/coëfficiënt) en het - teken (vóór de pijl neemt de concentratie af, dus is Δ[]/Δt negatief) zijn de uitkomsten aan elkaar gelijk.
Reactiesnelheid en concentratie
De orde van een reactie geeft aan op welke manier reactiesnelheid en concentratie met elkaar samenhangen:- A → … met s = k.[A] is een eerste ordereactie, waarin k de reactieconstante is
- 2 A → … met s = k.[A]2 is een tweede ordereactie
- A + B → … met s = k.[A].[B] is eveneens een tweede ordereactie
De orde is dus de som van de exponenten van de concentraties die in de formule voor de reactiesnelheid voorkomen.Concentraties die niet kunnen veranderen, zoals van een vaste stof, komen niet in deze formule voor.
 Afleiding formule 1e ordereactie
Afleiding formule 1e ordereactieEen eerste ordereactie, A → …
De vergelijking voor het verband tussen reactiesnelheid en concentratie is - Δ[A]/Δt = k.[A], hetgeen met Δt → 0 de differentiaalvergelijking -d[A]/dt = k.[A] oplevert.De oplossing wordt [A]t = [A]0e-k.t.
Eerste ordereactie in Excel
Er wordt gebruik gemaakt van een aantal algemene vaardigheden:- Een reeks getallen invoeren
- Een formule invoeren met verwijzing naar een reeks cellen
- Relatieve en absolute verwijzingen
Het werkblad voor een eerste ordereactie
Er worden twee grafieken gemaakt:- Concentratie tegen de tijd
- Reactiesnelheid tegen de tijd
Beginconcentratie, reactieconstante en de invloed van een katalysator kunnen worden ingesteld.
De opmaak van het werkblad
Type tekst en formules in zonder de aanhalingstekens. Opmaak werkblad 1e ordereactie
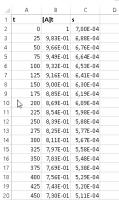
Opmaak werkblad 1e ordereactieZet in kolom A vanaf A2 de reeks 0 tot en met 5000 met een interval van 25
Zet in cel B2 "=G2" en in B3 "=$G$2*EXP(1)^(-$F$2*A3)"
Kopieer de inhoud van B3 naar beneden tot en met B202
Zet in cel C2 "=$F$2*B2" en kopieer de inhoud naar beneden tot en met C202
Zet in cel E2 "0,0007", in F2 "=E2*H2" en in G2 en H2 "1"
Maak kolom B en C op in de wetenschappelijke notatie door ze te selecteren en daarna in het geselecteerde gebied rechts te klikken
Kies voor Celeigenschappen, Getal, Wetenschappelijk in 2 decimalen
Doe dit ook voor cel E2 en F2
Selecteer cel H2 en kies bij GEGEVENS voor Gegevensvalidatie
Kies bij instellingen voor Toestaan, Decimaal tussen 0,1 en 10
Maak bij Invoerbericht de Titel "invloed katalysator" en bij Invoerbericht "0,1<getal<10 [ENTER]Geen katalysator is 1"
Maak de koppen vet en waar nodig passend
[/OLIST]
De grafieken invoegen
Het verloop van de concentratie tegen de tijd en van de reactiesnelheid tegen de tijd worden op het werkblad naast elkaar geplaatst.[OLIST]Selecteer cel A1 tot en met B202 en scroll weer omhoog
Kies onder INVOEGEN, Grafieken, Spreidings -(X,Y) of bellendiagram invoegen voor Spreiding met vloeiende lijnen
Verplaats de grafiek met de linkerbovenhoek in cel E4
Selecteer cel A1 tot en met A202 en cel C1 tot en met C202 en scroll weer omhoog
Voeg het tweede spreidingsdiagram in en schuif deze naar rechts tot hij het eerste diagram niet meer bedekt
Ga met de cursor over de horizontale as tot het label "As Horizontaal (waarde)" te zien is. Klik op de rechtermuisknop
Klik op As opmaken en zet het maximum op 5000, doe dit ook voor het andere diagram
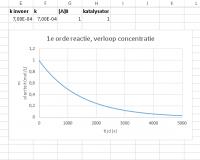
Klik op de grafiektitel van het eerste diagram en vervang [A]t door "1e ordereactie, verloop concentratie"
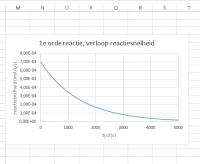
Maak de titel van het tweede diagram "1e ordereactie, verloop reactiesnelheid"
Klik ergens in het grafiekgebied en klik op de plus naast het diagram. Vink astitels aan.
Maak de horizontale astitels "tijd (s)", verticale astitel 1 "molariteit (mol/L) en astitel 2: reactiesnelheid (mol/L/s)
Sla het document op met de naam "reacties van de eerste orde.xlsx"[/OLIST]
Het gebruik van het werkblad
Het document reacties van de eerste orde.xlsx kan worden gedownload en geopend in Excel. Met het wijzigen van de variabele waarden veranderen de grafieken direct mee. Kijk eens naar de volgende situaties:Verandering beginconcentratie
Als de beginconcentratie wordt veranderd blijft de vorm van de grafieken hetzelfde, alleen de verticale as indeling wordt anders. Het is interessant om te kijken naar het moment dat de concentratie is gehalveerd, de halfwaardetijd. Die is voor een eerste ordereactie onafhankelijk van de beginconcentratie. Bij een k-waarde van 7.10-4 blijkt de halfwaardetijd tussen de 975 en 1000 seconde te liggen. Deze waarden zijn te vinden door met de muis over de lijn te gaan en de labels af te lezen.De halfwaardetijd is te berekenen met de formule t½ = 0,693/k
De formule voor het verval van een radioactieve stof is hetzelfde als die van een eerste ordereactie. De halfwaardetijden die daarbij voorkomen kunnen variëren van fracties van seconden tot miljarden jaren.
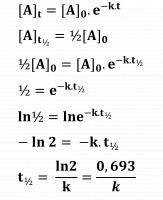 Verandering beginconcentratie: afleiding formule halfwaardetijd
Verandering beginconcentratie: afleiding formule halfwaardetijd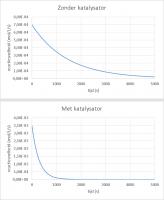 Gebruik katalysator: Invloed katalysator op reactiesnelheid
Gebruik katalysator: Invloed katalysator op reactiesnelheid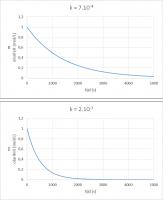 Gebruik katalysator: Invloed katalysator op verloop concentratie
Gebruik katalysator: Invloed katalysator op verloop concentratie