Elektrochemische cellen - redoxreacties
Opgaven met elektrochemische cellen komen vaak voor in de redoxchemie. Dit zijn opgaven waar zowel natuurkunde als scheikunde bij komen kijken. Dikwijls worden deze opgaven als lastig ervaren, terwijl dat helemaal niet zo hoeft te zijn. Met een bepaalde hoeveelheid oefening en achtergrondkennis over redoxreacties zijn deze opgaven een peulenschil. Wat is een elektrochemische cel, hoe ziet deze eruit, wat gebeurt er in een dergelijke cel en waar dient deze voor?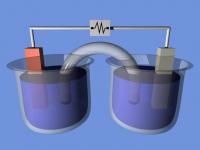 Figuur 1: Daniellcel / Bron: Alksub at English Wikipedia, Wikimedia Commons (CC BY-SA-3.0)
Figuur 1: Daniellcel / Bron: Alksub at English Wikipedia, Wikimedia Commons (CC BY-SA-3.0)Daniellcel
De elektrochemische cel, ook wel de Daniellcel (figuur 1) genoemd, bestaat uit twee bekerglazen met verschillende oplossingen. Deze zijn extern aan elkaar verbonden door een verbindende draad die elektronen transporteert van de ene elektrode naar de andere elektrode. Deze elektrodes hebben contact met de oplossing. Er kan gekozen worden om een voltmeter te plaatsen tussen deze elektrodes om zo het potentiaalverschil te kunnen meten. Het laatste onderdeel is de gebogen 'buis' die in beide oplossingen zit: dit is een zoutbrug, ook wel een agar-agarbrug, die ionen transporteert naar de bekerglazen en zorgt voor een gesloten stroomkring. Zonder de zoutbrug of de stroomdraad zal er geen reactie plaatsvinden. Ook zullen de elektronen nooit via de zoutbrug naar de andere oplossing gaan omdat deze weg veel meer weerstand heeft dan de geleidende stroomdraad. In de elektrotechniek geldt immers: elektronen nemen altijd het pad van de minste weerstand.Rekenen aan een Daniellcel - voorbeeld
Rekenen aan een Daniellcel is niet moeilijk. Hierbij is alleen het opstellen van half- en totaalreacties nodig, alsmede molair rekenen.Veronderstel dat in figuur 1 de oplossing waar de roodkoperen elektrode (links) in ondergedompeld zit een oplossing is van 1 M kopernitraat. In het bekerglas waar de zilveren elektrode (rechts) in ondergedompeld zit bevindt zich een oplossing van 1 M zilvernitraat. Beide elektroden zijn 5,00 gram. Als de stroomkring wordt onderbroken na 7 minuten is de zilveren elektrode dikker geworden, en de koperen elektrode dunner. De massa van de zilverelektrode is 6,17 gram. Hoeveel gram koper heeft gereageerd, en hoeveel Ampère is er uiteindelijk door de draad gegaan?
Uitleg
Een dergelijke vraag zou als volgt moeten worden aangepakt: eerst moeten de halfreacties worden opgesteld van de betrokken stoffen. Vervolgens moet er worden gekeken naar in welke verhouding dezer stoffen met elkaar reageren. Daarna moeten de hoeveelheid mol van elke stof worden berekend. De hoeveelheid mol van een stof is daarnaast ook gekoppeld aan de hoeveelheid elektronen die door de draad is gegaan. Een stof die van oxidatiegetal 3+ naar 0 is gegaan heeft drie elektronen opgenomen per ion. In dat geval moet de hoeveelheid mol stof die van 3+ naar 0 is gegaan met drie moeten worden vermenigvuldigd, want dat is de hoeveelheid elektronen (in mol) die een reactie hebben bewerkstelligd. Voor stoffen die andere oxidatiegetallen hebben (2+, 1+) dient de hoeveelheid mol met dat getal te worden vermenigvuldigd om het aantal elektronen te vinden. Vergeet daarnaast niet om dit getal met de constante van Avogadro te vermenigvuldigen om het absolute aantal elektronen te vinden. Dit getal kan vervolgens worden vermenigvuldigd met het elementair ladingsquantum e, wat gelijk is aan 1,602176565 * 10-19 Coulomb per elektron. Dit getal delen door de tijd in seconden geeft een stroom in Ampère. Namelijk, één Coulomb is gelijk aan één Ampere * seconde.
Deze vraag kan het best beantwoord worden door eerst de halfreacties op de stellen. Klaarblijkelijk reageert koper weg en wordt de zilverelektrode dikker door neerslag van zilver op de elektrode. Oftewel, de koperelektrode is de reductor en de zilver-ionen in de oplossing zijn de oxidator. Dit geeft de volgende halfreacties:
Er is bij de zilverelektrode 6,17 - 5,00 = 1,17 gram zilver neergeslagen. Dit is 1,17 / 107,87 = 0,01084638917 mol zilver. Zilver en koper reageren in verhouding Ag:Cu = 2:1 met elkaar, wat betekent dat 0,00542319458 mol koper heeft gereageerd. Dit is 0,00542319458 * 63,546 = 0,345 gram koper.
Het aantal elektronen dat door de draad is gegaan is gelijk aan de hoeveelheid zilver die is neergeslagen. Elk zilver-ion kan namelijk één elektron opnemen. Andersom kan worden beredeneerd dat elk koperatoom twee elektronen afstaat. Oftewel, 0,01084638917 mol elektronen is door de draad gegaan. Vermenigvuldigen met het getal van Avogadro geeft dan 0,01084638917 * 6,02214 * 1023 = 6,532 * 1021 elektronen. Dit vermenigvuldigen met 1,602176565*10-19 geeft 1046,5 Coulomb. Een Coulomb is een Ampère-seconde, dus delen door 7 * 60 geeft 2,5 Ampère.
- Ag+ + e- → Ag (s) met E = +0,80 V
- Cu (s) → Cu2+ + 2 e- met E = +0,34 V
- Totaalreactie is dan 2 Ag+ + Cu (s) → 2 Ag (s) + Cu2+
Er is bij de zilverelektrode 6,17 - 5,00 = 1,17 gram zilver neergeslagen. Dit is 1,17 / 107,87 = 0,01084638917 mol zilver. Zilver en koper reageren in verhouding Ag:Cu = 2:1 met elkaar, wat betekent dat 0,00542319458 mol koper heeft gereageerd. Dit is 0,00542319458 * 63,546 = 0,345 gram koper.
Het aantal elektronen dat door de draad is gegaan is gelijk aan de hoeveelheid zilver die is neergeslagen. Elk zilver-ion kan namelijk één elektron opnemen. Andersom kan worden beredeneerd dat elk koperatoom twee elektronen afstaat. Oftewel, 0,01084638917 mol elektronen is door de draad gegaan. Vermenigvuldigen met het getal van Avogadro geeft dan 0,01084638917 * 6,02214 * 1023 = 6,532 * 1021 elektronen. Dit vermenigvuldigen met 1,602176565*10-19 geeft 1046,5 Coulomb. Een Coulomb is een Ampère-seconde, dus delen door 7 * 60 geeft 2,5 Ampère.