Alcoholen als reductor - theorie
Redoxreacties zijn reacties waarbij ladingen verschuiven. Meestal komen redoxreacties voor tussen twee metalen, twee niet-metalen of tussen een niet-metaal en een metaal. Toch kunnen organische stoffen ook reageren als een reductor of oxidator. De redoxreacties bij alcoholen zijn van belang voor de verwerking van ethanol in het menselijk lichaam: de reductie van ethanol zorgt voor afbreekbare producten.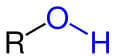 Figuur 1: een hydroxylgroep. R vertegenwoordigt het koolstofskelet. / Bron: NEUROtiker, Wikimedia Commons (Publiek domein)
Figuur 1: een hydroxylgroep. R vertegenwoordigt het koolstofskelet. / Bron: NEUROtiker, Wikimedia Commons (Publiek domein)Wat zijn alcoholen?
Alcoholen zijn organische moleculen (koolwaterstoffen) waaraan een -OH-groep, ook wel de hydroxylgroep genaamd, is gebonden. In figuur 1 is afgebeeld hoe een hydroxylgroep is gebonden aan een koolwaterstof. Een alcohol is goed oplosbaar in water door de hydroxylgroep, die het molecuul de mogelijkheid geeft om waterstofbruggen te slaan met andere polaire moleculen. Om goed oplosbaar te zijn moet het apolaire koolstofskelet afgestemd zijn op de hoeveelheid hydroxylgroepen in het molecuul: als het molecuul lang is en er zijn relatief weinig hydroxylgroepen, dan zal het moeilijker zijn om de stof op te lossen. Andersom geldt ook dat een kleiner molecuul met minder hydroxylgroepen makkelijker oplost, en dat een langer molecuul met meer hydroxylgroepen makkelijker oplost. De oplosbaarheid van alcoholen is, kortom, te bepalen aan twee kwaliteiten:- De lengte van het apolaire koolstofskelet
- De mate waarin hydroxylgroepen aanwezig zijn
De hydroxylgroep
Zoals in figuur 1 staat afgebeeld bestaat de hydroxylgroep uit een -OH-binding. Omdat de hydroxylgroep de eigenschappen van een organisch molecuul significant kunnen aanpassen wordt het een functionele groep genoemd binnen de organische chemie. Bij functionele groepen horen voor- en achtervoegsels, die in het tabel hieronder voor de hydroxylgroep is uitgezet:
| Functionele groep | Prioriteit | Voorvoegsel | Achtervoegsel |
|---|---|---|---|
| Hydroxyl | Belangrijker dan aminen, minder belangrijk dan ketonen | hydroxy- | -ol |
Soorten alcoholen
Wanneer met alcoholen wordt gewerkt zijn er drie soorten te benoemen. Dit is afhankelijk van de bindingslocatie van de hydroxylgroep, die een alcohol een primair, secundair of een tertiair alcohol kan maken.Primaire alcoholen - redox
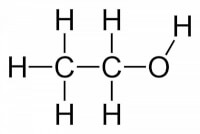 Figuur 2: ethanol, een primair alcohol / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)
Figuur 2: ethanol, een primair alcohol / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)CH3CH2OH →CH2CHO + 2 H+ + 2 e-
De volgende stap is een reactie in aangezuurd milieu. Omdat deze reactie volgens katalyse verloopt en pas op het einde een redoxreactie vertoont, wordt alleen de redoxreactie vertoond. Bij deze reactie wordt een zogenoemd diol gevormd, een primair di-alcohol. De halfreactie voor deze laatste stap gaat als volgt:R-CH(OH)2 → R-COOH + 2 H+ + 2 e-
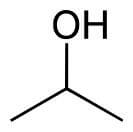 Figuur 3: propaan-2-ol / Bron: Yikrazuul, Wikimedia Commons (Publiek domein)
Figuur 3: propaan-2-ol / Bron: Yikrazuul, Wikimedia Commons (Publiek domein)Secundaire alcoholen zijn alcoholen waarbij het koolstofatoom waaraan de hydroxylgroep is gebonden, ook is gebonden aan twee koolstofatomen. Een voorbeeld van een dergelijk alcohol is afgebeeld in figuur 3. Omdat een redoxreactie met een organische stof niet de stof opbreekt betekent dit dat een dergelijk molecuul alleen kan reduceren tot keton. De dubbelgebonden zuurstof (ook wel de carbonylgroep) bevindt zich niet aan het begin van een molecuul, waardoor het geen aldehyde is. Door deze eigenschap kan een secundair alcohol alleen reduceren tot keton, en niet verder tot een carboxylgroep, ook wel een zuurgroep genoemd). Dit is te verklaren door te kijken naar het aantal bindingen waaraan de ketongroep vastzit. Een zuurgroep beschikt over een dubbelgebonden zuurstof en een hydroxylgroep op hetzelfde koolstofatoom, waardoor er ruimte is voor 1 andere binding; dikwijls een ander koolstofatoom. Omdat een secundair alcohol reduceert tot keton zijn er al twee bindingen gereserveerd voor aangrenzende koolstofatomen, waardoor een carboxylgroep onmogelijk is op dat koolstofatoom.
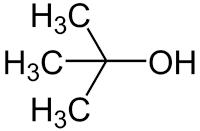 Figuur 4: 2-methylpropaan-2-ol / Bron: Dschanz, Wikimedia Commons (Publiek domein)
Figuur 4: 2-methylpropaan-2-ol / Bron: Dschanz, Wikimedia Commons (Publiek domein)Een tertiair alcohol beschikt over een koolstofatoom met een hydroxylgroep en drie aangrenzende koolstofatomen. Een voorbeeld van een dergelijk alcohol is afgebeeld in figuur 4. Dit is een type alcohol dat niet zal reageren als reductor omdat er geen elektronen meer vrij zijn op het koolstofatoom waaraan de hydroxylgroep gebonden is. Hierdoor kan het koolstofatoom geen sterkere binding aangaan met het zuurstof en is de formatie van een keton in een tertiair alcohol uitgesloten.