Scheikunde: Systematische naamgeving in de organische chemie
 In de organische scheikunde worden bepaalde namen gebruikt voor stoffen om duidelijk te maken welke functionele groepen aanwezig zijn in het molecuul. Deze regels worden vastgesteld door de IUPAC, de International Union of Pure and Applied Chemistry. De regels die worden gebruikt bij de naamgeving worden zowel in het onderwijs als de industrie gebruikt, vaak naast de triviale naamgeving. Hoe zitten de regels in elkaar?
In de organische scheikunde worden bepaalde namen gebruikt voor stoffen om duidelijk te maken welke functionele groepen aanwezig zijn in het molecuul. Deze regels worden vastgesteld door de IUPAC, de International Union of Pure and Applied Chemistry. De regels die worden gebruikt bij de naamgeving worden zowel in het onderwijs als de industrie gebruikt, vaak naast de triviale naamgeving. Hoe zitten de regels in elkaar?
Organische chemie
De organische chemie is overal om de mens heen: benzine in de auto, het gas uit het gasfornuis en de meeste stoffen in het menselijk lichaam zijn organisch. Dat houdt in dat deze moleculen uit koolstof (C), waterstof (H) en in sommige gevallen zuurstof (O) en stikstof (N) bestaan. In de organische chemie wordt zowel gebruik gemaakt van de lengte- en positieaanduiding, de prioriteiten alsmede de functionele groepen:- Lengte-aanduiding
- Positie-aanduiding
- Prioriteiten
- Alkanen
- Alkenen
- Alkynen
- Cyclische verbindingen
- Aromatische verbindingen
- Functionele groepen
Lengte-aanduiding
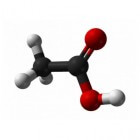
De lengte van een koolwaterstof wordt aangeduid met behulp van voorvoegsels, zogenoemde prefixes. Deze voorvoegsels zijn, uiteraard, verschillend voor elke lengte. Deze voorvoegsels komen voor de aanduiding van het soort koolwaterstof. In figuur 1 is een voorbeeld hiervan gegeven. Een alkaan, bestaande uit een lengte van drie koolstofatomen, krijgt het voorvoegsel prop- en achtervoegsel -aan, waardoor de naam van deze stof propaan is. Hiervan zijn nog meer voorbeelden te geven, maar waar de naamgeving op neerkomt bij simpele stoffen zoals in figuur 1, dus zonder vertakkingen of functionele groepen, is voorvoegsel (meth-, eth-, prop- enzovoort) + achtervoegsel (-aan, -een, -yn enzovoort). Soms komt het voor dat een molecuul een vertakking heeft, of een dubbele (of zelfs driedubbele) binding. In dat geval kiest men als hoofdreeks het gedeelte waarin alle dubbele bindingen voorkomen. Indien deze afwezig zijn is de hoofdreeks gelijk aan de langste reeks.| Lengte | Voorvoegsel |
|---|---|
| 1 | meth- |
| 2 | eth- |
| 3 | prop- |
| 4 | but- |
| 5 | pent- |
| 6 | hex- |
| 7 | hept- |
| 8 | oct- |
| 9 | non- |
| 10 | dec- |
Positie-aanduiding
Positie-aanduidingen in de organische chemie zijn van groot belang om aan te geven waar in het molecuul een vertakking zit en of er functionele groepen aanwezig zijn. Zonder positie-aanduiding zou de naamgeving te gecompliceerd worden waardoor stoffen dan met elkaar verward kunnen worden. Om dat te voorkomen geeft men de positie aan met cijfers. Deze cijfers worden voor de functionele groep (vertakking etc.) geplaatst, of tussen de voor- en achtervoegsel van het molecuul als het gaat om een dubbele binding. Enkele voorbeelden ter referentie staan weergegeven in figuren 2, 3 en 4.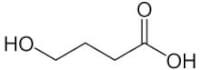 Figuur 2: 4-hydroxybutaanzuur / Bron: NEUROtiker, Wikimedia Commons (Publiek domein)
Figuur 2: 4-hydroxybutaanzuur / Bron: NEUROtiker, Wikimedia Commons (Publiek domein)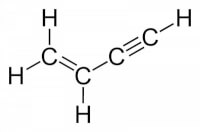 Figuur 3: But-1-een-3-yn / Bron: Publiek domein, Wikimedia Commons (PD)
Figuur 3: But-1-een-3-yn / Bron: Publiek domein, Wikimedia Commons (PD)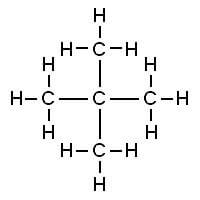 Figuur 4: 2,2-dimethylpropaan / Bron: H Padleckas, Wikimedia Commons (Publiek domein)
Figuur 4: 2,2-dimethylpropaan / Bron: H Padleckas, Wikimedia Commons (Publiek domein)Deze figuren geven aan waarmee rekening moet worden gehouden: Ten eerste de hoeveelheid vertakkingen. In figuur 4 zijn twee dezelfde vertakkingen aanwezig. In dit geval noteert men dit door het nummer van het koolstofatoom te noteren waar de vertakking zich bevindt. Omdat het twee vertakkingen zijn moet dit twee keer. Daarnaast komt het voorvoegsel di voor de naam van de groep: dimethyl. In de figuren 2 en 3 zijn andere functionele groepen aanwezig, die niet op hetzelfde koolstofatoom voorkomen.
Prioriteiten
Vanwege de vele verschillende functionele groepen kreeg men te maken met problemen in de naamgeving. Om de problemen in de naamgeving op te lossen is een prioriteitenstelsel opgesteld waarin alle functionele groepen, tezamen met hun voor- en achtervoegsels staan uitgezet. De achtervoegsels kunnen alleen worden gebruikt indien die functionele groep de hoogste prioriteit heeft in het molecuul. In het onderstaande tabel staan de functionele groepen uitgezet, alsmede hun prioriteit, voor- en achtervoegsels.| Prioriteit | Functionele groep | Voorvoegsel | Achtervoegsel |
|---|---|---|---|
| 1* | Carbonzuur (-COOH) | geen | -zuur |
| 2 | Sulfonzuur (-SOOOH) | geen | -sulfonzuur |
| 3 | Zuuranhydride (-COOCO-) | geen | -zuuranhydride |
| 4* | Ester (-COO-) | geen | -oaat |
| 5 | Zuurchloride (-COCl) | geen | -oylchloride |
| 6* | Amiden (-CONH2, -CONH-, CON<) | geen | amide |
| 7* | Nitril (-CN) | cyaan- | -nitril |
| 8* | Aldehyde (-CHO) | oxo- | -al |
| 9* | Keton (>CO) | oxo- | -on |
| 10* | Alcohol (-OH) | hydroxy- | -ol |
| 11 | Fenol (-OH) | hydroxy- | -ol |
| 12* | Thiol (-SH) | sulfanyl- | -thiol |
| 13* | Aminen (-NH2, -NH-, -N<) | amino-, N-alkylamino, N-alkyl-N-alkyl'amino | -amine, -N-alkylkamine, N-alkyl-N-alkyl'... amine |
| 14* | Ether (-O-) | alkoxy- | geen |
| 15* | Halogenen (-F, -Cl, -Br, -I) | Fluor-, chloor-, broom-, jood- | geen |
| 16* | Nitro (-NO2) | nitro- | geen |
Alkanen
Alkanen zijn de simpelste koolwaterstoffen in de organische chemie. Alkanen zijn verzadigde koolwaterstoffen. Dat houdt in dat er geen dubbele bindingen zich bevinden in het molecuul en koolstofatomen dus met enkele bindingen aan andere atomen, dikwijls waterstofatomen, gebonden zijn. Alkanen hebben als algemene moleculaire formule CnH2n+2. In figuur 4 staat een voorbeeld van een alkaan met een vertakking. Er zijn 5 koolstofatomen te tellen, dat zou moeten betekenen volgens de formule dat er 2 * 5 + 2 = 12 waterstofatomen aanwezig moeten zijn in het molecuul in figuur 4. In figuur 2 of 3 kan deze formule niet worden toegepast: omdat in figuur 2 functionele groepen aanwezig zijn en in figuur 3 een koolwaterstof met dubbele binding staat afgebeeld, geldt de formule niet. De algemene formule geldt alleen bij kale alkanen, waarbij vertakkingen zijn toegestaan (mits deze ook alleen enkelvoudige bindingen bevatten). De uitgang is altijd -aan bij deze moleculen. In figuur 1 is bijvoorbeeld een molecuul afgebeeld met een lengte van 3 koolstofatomen. In de lengte-aanduidingen kan worden afgelezen dat een lengte van drie het voorvoegsel prop- krijgt. Omdat zich geen andere functionele groepen bevinden in het molecuul en er alleen enkele bindingen aanwezig zijn, kan het achtervoegsel voor alkanen gewoon bij het voorvoegsel worden gevoegd. Zo is de naam van de stof in figuur 1 te achterhalen: propaan, met moleculaire formule C3H8. Indien een alkaan deel uitmaakt van een molecuul middels een vertakking, dan krijgt het vertakte alkaan het achtervoegsel -yl, zoals in figuur 4.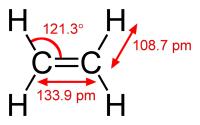 Figuur 5: etheen / Bron: Ben Mills, Wikimedia Commons (Publiek domein)
Figuur 5: etheen / Bron: Ben Mills, Wikimedia Commons (Publiek domein)Alkenen
In veel gevallen kunnen er dubbele bindingen aanwezig zijn in het molecuul. Moleculen zoals in figuur 5 noemen we alkenen. Alkenen zijn min of meer hetzelfde als alkanen, alleen zit het verschil in de aanwezigheid van de dubbele binding. Alkanen kunnen op onder meer de volgende manieren worden vervaardigd:- Dehydrogenatie van alcoholen
- Kraken
Alkenen verschillen daarnaast van alkanen in hun sterische inrichting (alkenen hebben een driehoekige, platte structuur bij de dubbele binding, alkanen hebben een tetraëdrische structuur), reactiewarmte en benaming. Daarnaast worden de dubbele bindingen in een molecuul vrijwel altijd meegenomen in de langste keten van het molecuul, om zo benoemingen van vertakkingen met dubbele bindingen te vermijden. Alkenen krijgen altijd het achtervoegsel -een, zoals in figuur 5. In het geval dat een segment met een dubbele binding toch als vertakking moet worden genomen, is het achtervoegsel van de vertakking -enyl.
Alkynen
Alkynen beschikken over een drievoudige binding. Hun sterische inrichting is lineair, in tegenstelling tot de driehoekige alkeen en de tetraëdrische alkaan. Het achtervoegsel van een alkyn is -yn indien het gedeelte van een alkyn het belangrijkste segment is in het molecuul. Een vertakking van een alkyn wordt aangeduid met -ynyl als achtervoegsel bij de vertakking.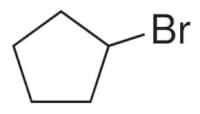 Figuur 6: (1-)broomcyclopentaan / Bron: Rachelb6UA2015, Wikimedia Commons (CC BY-SA-3.0)
Figuur 6: (1-)broomcyclopentaan / Bron: Rachelb6UA2015, Wikimedia Commons (CC BY-SA-3.0)Cyclische verbindingen
Cyclische verbindingen zijn organische stoffen waarbij geen duidelijk begin en eind aanwezig zijn. Deze stoffen fungeren min of meer hetzelfde als alkanen, alkenen of alkynen: ze vertonen enkele, dubbele of drievoudige bindingen en kunnen vertakking houden. De benaming voor een cyclisch molecuul begint met het voorvoegsel cyclo-. In figuur 6 staat een voorbeeld van een dergelijke cycloverbinding. Vanwege de aanwezigheid van uitsluitend enkele verbindingen is de naam van het cyclische gedeelte cyclopentaan. De halogeen op positie 1 (die in dit geval niet verplicht hoeft worden te aangegeven) geeft nog een voorvoegsel in de naam: broom-. Hierdoor is de naam van de stof in figuur 6 (1-)broomcyclopentaan.Aromatische verbindingen
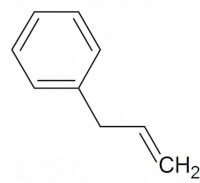 Figuur 7: 3-fenylprop-1-een / Bron: Jacopo Werther, Wikimedia Commons (Publiek domein)
Figuur 7: 3-fenylprop-1-een / Bron: Jacopo Werther, Wikimedia Commons (Publiek domein)| Functionele groep | Voorvoegsel | Achtervoegsel |
|---|---|---|
| Benzeen | Fenyl- | -benzeen |
Functionele groepen
In de organische chemie kunnen de conventionele waterstofatomen, die zijn gebonden aan een koolstofatoom, vervangen worden door functionele groepen. Deze functionele groepen geven het molecuul veranderende eigenschappen: de smelt- en kooktemperaturen kunnen veranderen, de oplosbaarheid in water kan veranderen of het molecuul heeft een andere geur. Zo worden esterverbindingen (bindingen tussen zuren en alcoholen) gebruikt als geurstof, en zijn alcoholen oplosbaar (afhankelijk van de lengte) in water. De volgende functionele groepen zijn van groot belang in de koolstofchemie:- Halogenen
- Nitroverbindingen
- Ethers
- Aminen
- Thiolen en alcoholen
- Ketonen en aldehyden
- Carbonzuren en esters
Halogenen
De halogenen zijn elementen die voorkomen in groep 17 van het periodieke systeem der elementen. Deze elementen komen altijd di-atomair voor en kunnen aan een koolwaterstof worden toegevoegd middels een substitutiereactie of een additiereactie. Bij een substitutiereactie wordt een waterstofatoom vervangen voor een halogeen en wordt een ander molecuul, een zogenoemd waterstofhalide gevormd en uitgestoten. Deze reactie komt enkel voor bij alkanen, vanwege de afwezigheid van een dubbele binding. In figuur 8 reageert chloor met methaan in een substitutiereactie, om chloormethaan te vormen. Halogenen hebben enkel een achtervoegsel:| Functionele groep (Halogeen) | Voorvoegsel | Achtervoegsel |
|---|---|---|
| Chloor | Chloor- | geen |
| Fluor | Fluor- | geen |
| Broom | Broom- | geen |
| Jood | Jood- | geen |
Nitroverbindingen
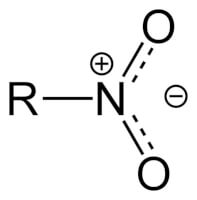 Figuur 10: de nitro-groep / Bron: Publiek domein, Wikimedia Commons (PD)
Figuur 10: de nitro-groep / Bron: Publiek domein, Wikimedia Commons (PD)| Functionele groep | Voorvoegsel | Achtervoegsel |
|---|---|---|
| Nitro | Nitro- | geen |
Ethers
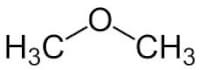 Figuur 11: methoxymethaan / Bron: Jü, Wikimedia Commons (Publiek domein)
Figuur 11: methoxymethaan / Bron: Jü, Wikimedia Commons (Publiek domein)| Functionele groep | Voorvoegsel | Achtervoegsel |
|---|---|---|
| Ether | alkoxy- | geen |
Aminen
Onder de stikstofhoudende verbindingen vallen de aminen. Aminen zijn te herkennen aan de aanwezigheid van een -NH2, -NH- of een -N<-groep. Deze stoffen zijn doorgaans vluchtig, hebben een lage kooktemperatuur en lossen goed tot voldoende op in water. Dit komt omdat de -NH2 en de -NH-groep waterstofbruggen kunnen slaan met watermoleculen. Daarnaast wordt de oplossing van een amine in water basisch, omdat het vrije elektronenpaar op het stikstofatoom een H+ kan opnemen. Aminen zijn makkelijk te benoemen, alleen moet er rekening worden gehouden met prioriteiten. Aminen hebben namelijk een voor- en achtervoegsel, waardoor naamgeving wat moeilijker is.| Functionele groep | Voorvoegsel | Achtervoegsel |
|---|---|---|
| Aminen | N-alkyl-N-alkyl'amino- | N-alkyl-N-alkyl'... amine |
Thiolen en alcoholen
Alcohol kent vrijwel iedereen als drinkbare alcohol. Toch is de benaming officieel niet correct, omdat alcohol een functionele groep is. Het drinkbare alcohol heet, volgens de systematische naamgeving, ethanol. Alcoholen zijn goed oplosbaar in water vanwege de aanwezigheid van een -OH-groep: hoe meer van deze groepen, hoe beter een molecuul oplost in water en hoe hoger de kooktemperatuur van deze stof. Dit komt door de hoeveelheid waterstofbruggen die kunnen worden geslagen: per -OH-groep kunnen drie waterstofbruggen worden geslagen. Daarnaast worden alcoholen ook gebruikt als (toevoeging in) (bio)brandstof, ontsmettingsmiddel, antivries, oplosmiddel of in industriële processen om andere stoffen te produceren; zo kan een alcohol in een redoxreactie reageren tot een keton of aldehyde. Dit is afhankelijk van het type alcohol. Thiolen zijn bijna identiek aan alcoholen, maar thiolen beschikken over een -SH-groep. Hierdoor zijn de eigenschappen van een thiol anders: de -SH-groep is minder polair ten opzichte van een -OH-groep. Ook kunnen -SH-groepen geen waterstofbruggen vormen, maar de vanderwaalskrachten tussen -SH-houdende moleculen zijn groter dan die van -OH-houdende moleculen. Vanwege de sterkere aard van een waterstofbrug heeft dit weerslag op de kooktemperatuur van moleculen: -SH-houdende moleculen verdampen bij een lagere temperatuur dan een identiek molecuul met een -OH-groep in plaats van een -SH-groep. Een ander verschil zit in de naamgeving en prioriteit: alcoholen hebben een hogere prioriteit dan thiolen.| Functionele groep | Voorvoegsel | Achtervoegsel |
|---|---|---|
| Alcohol | hydroxy- | -ol |
| Thiol | sulfanyl- | -thiol |
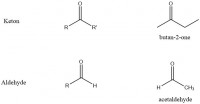 Figuur 12: verschil tussen keton en aldehyde
Figuur 12: verschil tussen keton en aldehydeKetonen en aldehyden
Alcoholen kunnen doorreageren in redoxreacties tot ketonen en aldehyden. Dit gebeurt ook in het menselijk lichaam bij de afbraak van ethanol. Ketonen en aldehyden zijn vrijwel identiek aan elkaar: allebei is er sprake van een dubbelgebonden zuurstof aan een koolstofatoom, alleen de positie van het koolstofatoom waaraan de dubbelgebonden zuurstof zit is van belang. Een organisch molecuul is een aldehyde wanneer een zuurstofatoom aan het laatste koolstofatoom is gebonden. Bij een keton moeten de atomen die grenzen aan het koolstofatoom met het dubbelgebonden zuurstofatoom ook koolstofatomen zijn. In figuur 12 is dit afgebeeld: de R- en R'-groepen moeten alkylgroepen zijn. De benaming verschilt lichtelijk, ook is de aldehyde superieur ten opzichte van het keton.| Functionele groep | Voorvoegsel | Achtervoegsel |
|---|---|---|
| Aldehyde | oxo- | -al |
| Keton | oxo- | -on |
Carbonzuren en esters
De functionele groep met de hoogste prioriteit is de carbonzuur. De carbonzuur heeft de mogelijkheid water te protoneren (een carbonzuur is dikwijls een zwak zuur) waardoor de pH van de oplossing daalt. Dit is ten dele afhankelijk van de lengte van de koolstofstaart: methaanzuur is een iets sterker zuur dan ethaanzuur. Carbonzuren kunnen reageren met alcoholen in een zogenaamde veresteringsreactie, waarbij een watermolecuul wordt afgescheiden. De benamingen van de ontstane stoffen in figuur 13 staan onder de afbeelding in het rood aangegeven. Bij esters wordt eerst de alkylgroep die is verbonden aan de -COO-groep benoemd, in figuur 13 is dit methyl. Vervolgens wordt het gedeelte met de -COO-groep benoemd: in figuur 13 is dit ethanoaat, waardoor de naam van de gevormde stof methyl ethanoaat is.| Functionele groep | Voorvoegsel | Achtervoegsel |
|---|---|---|
| Carbonzuur | geen | -zuur |
| Esters | geen | -oaat |
© 2017 - 2025 Dysprosium, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Isomeren: de verschillende soortenBinnen de scheikunde komen veel isomeren voor. Isomeren zijn stoffen die hetzelfde aantal en dezelfde soorten atomen bev…
Isomeren: de verschillende soortenBinnen de scheikunde komen veel isomeren voor. Isomeren zijn stoffen die hetzelfde aantal en dezelfde soorten atomen bev…
 Scheikunde - naamgeving koolstofketensHet geven van een naam aan koolstofketens wordt in de scheikunde veel gedaan. Wanneer je de basisregels van het naamgeve…
Scheikunde - naamgeving koolstofketensHet geven van een naam aan koolstofketens wordt in de scheikunde veel gedaan. Wanneer je de basisregels van het naamgeve…
 Samenvatting ScheikundeSamenvatting Scheikunde :vanderwaalsbinding, elektronenegaviteit, dipolen, waterstofbruggen en hydrofiele en hydrofobe s…
Samenvatting ScheikundeSamenvatting Scheikunde :vanderwaalsbinding, elektronenegaviteit, dipolen, waterstofbruggen en hydrofiele en hydrofobe s…
 Massapercentage berekenen - theorie en voorbeeldenIn de scheikunde moeten veel dingen worden berekend: de E-factor, de hoeveelheid mol of een percentage. Vaak zijn zulke…
Massapercentage berekenen - theorie en voorbeeldenIn de scheikunde moeten veel dingen worden berekend: de E-factor, de hoeveelheid mol of een percentage. Vaak zijn zulke…
 Alcoholen als reductor - theorieRedoxreacties zijn reacties waarbij ladingen verschuiven. Meestal komen redoxreacties voor tussen twee metalen, twee nie…
Alcoholen als reductor - theorieRedoxreacties zijn reacties waarbij ladingen verschuiven. Meestal komen redoxreacties voor tussen twee metalen, twee nie…
Gerelateerde artikelen
Organische en anorganische chemieBinnen de chemie (scheikunde) houdt men zich bezig met allerlei chemische verbindingen. Deze verbindingen bestaan uit ve…
Bronnen en referenties
- Inleidingsfoto: OpenClipart Vectors, Pixabay
- https://www.edumedia-sciences.com/nl/media/701-verestering
- https://chem.libretexts.org/Core/Organic_Chemistry/Alcohols/Properties_of_Alcohols/Uses_of_Alcohols
- http://www.chemguide.co.uk/organicprops/amines/background.html
- http://www.acdlabs.com/iupac/nomenclature/
- Afbeelding bron 1: Walkerma, Wikimedia Commons (CC0)
- Afbeelding bron 2: NEUROtiker, Wikimedia Commons (Publiek domein)
- Afbeelding bron 3: Publiek domein, Wikimedia Commons (PD)
- Afbeelding bron 4: H Padleckas, Wikimedia Commons (Publiek domein)
- Afbeelding bron 5: Ben Mills, Wikimedia Commons (Publiek domein)
- Afbeelding bron 6: Rachelb6UA2015, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 7: Jacopo Werther, Wikimedia Commons (Publiek domein)
- Afbeelding bron 8: V8rik, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 9: Polimerek, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 10: Publiek domein, Wikimedia Commons (PD)
- Afbeelding bron 11: Jü, Wikimedia Commons (Publiek domein)
Dysprosium (40 artikelen)
Laatste update: 27-01-2021
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 16
Laatste update: 27-01-2021
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 16
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.
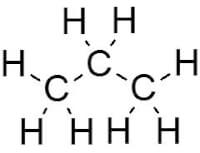 Figuur 1: propaan /
Figuur 1: propaan /