Massapercentage berekenen - theorie en voorbeelden
 In de scheikunde moeten veel dingen worden berekend: de E-factor, de hoeveelheid mol of een percentage. Vaak zijn zulke percentages volumepercentages of massapercentages. Een massapercentage berekenen wordt vaak als moeilijk ervaren omdat het overzicht snel kwijt is. Door simpele stappen te volgen wordt de berekening al gauw overzichtelijker en zijn de handelingen beter te overzien. Hierdoor is tijd te besparen en kunnen dergelijke problemen snel en effectief worden opgelost.
In de scheikunde moeten veel dingen worden berekend: de E-factor, de hoeveelheid mol of een percentage. Vaak zijn zulke percentages volumepercentages of massapercentages. Een massapercentage berekenen wordt vaak als moeilijk ervaren omdat het overzicht snel kwijt is. Door simpele stappen te volgen wordt de berekening al gauw overzichtelijker en zijn de handelingen beter te overzien. Hierdoor is tijd te besparen en kunnen dergelijke problemen snel en effectief worden opgelost.Massapercentage
Een massapercentage geeft per definitie een massa-aandeel van een bepaalde stof aan in een andere stof. Massapercentages worden vaak aangehaald als mate van concentratie (zo wordt volumeprocent ook vaak gebruikt als mate van concentratie, zoals alcoholpercentages) in een gegeven stof. Het berekenen van een massapercentage lijkt een moeilijke taak. Echter aan de hand van enkele voorbeelden wordt laten zien dat het berekenen geen moeilijke taak is.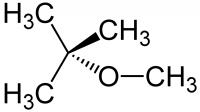 Figuur 1: MTBE / Bron: J?rgen Martens, Wikimedia Commons (CC BY-SA-3.0)
Figuur 1: MTBE / Bron: J?rgen Martens, Wikimedia Commons (CC BY-SA-3.0)Voorbeeld 1: Zuurstof in MBTE
MBTE, ook wel bekend als methyl-tert-butyl ether of 2-methoxy-2-methylpropaan (figuur 1), is een vluchtige (snel-verdampende) stof waar zuurstof in voorkomt. Bereken het massapercentage van zuurstof in MTBE.De eerste stap in het oplossen van de opgave is het vaststellen van de moleculaire formule van MTBE. Daarna moet de moleculaire massa van MTBE worden berekend, alsmede de moleculaire massa van zuurstof. De moleculaire massa van zuurstof wordt vervolgens vermenigvuldigd met de hoeveelheid zuurstofatomen in het molecuul, en dat getal wordt gedeeld door de moleculaire massa van MTBE. Het getal dat uit die berekening komt wordt op zijn beurt vermenigvuldigd met 100%, en het massapercentage van zuurstof in MTBE is de uitkomst van die berekening.
Moleculaire formule MTBE: C5H12O
Moleculaire massa MTBE: (5 * 12,01) + (12 * 1,008) + (1 * 16,00) = 60,05 + 12,096 + 16,00 = 88,146 gram per mol
Molaire massa O: 16,00 gram per mol
1 zuurstofatoom in C5H12O, dus 16,00 gram O per mol C5H12O.
(16,00 / 88,146) * 100% = 18,15%
Het massa-aandeel van zuurstof in MTBE is 18,15%
Moleculaire massa MTBE: (5 * 12,01) + (12 * 1,008) + (1 * 16,00) = 60,05 + 12,096 + 16,00 = 88,146 gram per mol
Molaire massa O: 16,00 gram per mol
1 zuurstofatoom in C5H12O, dus 16,00 gram O per mol C5H12O.
(16,00 / 88,146) * 100% = 18,15%
Het massa-aandeel van zuurstof in MTBE is 18,15%
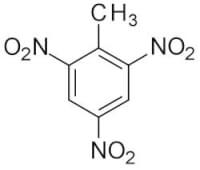 Figuur 2: 1-methyl-2,4,6-trinitrobenzeen / Bron: Publiek domein, Wikimedia Commons (PD)
Figuur 2: 1-methyl-2,4,6-trinitrobenzeen / Bron: Publiek domein, Wikimedia Commons (PD)Voorbeeld 2: TNT
TNT (figuur 2) is een explosieve stof en wordt ook als dusdanig gebruikt bij het ruimen van grote stenen of in de mijnbouw. Bereken het massapercentage van stikstof en zuurstof in TNT.In dit geval moeten er twee andere variabelen worden berekend: het aandeel zuurstof en het aandeel stikstof. De berekening verandert vrijwel niet, behalve dat een extra stap wordt toegevoegd aan de berekening.
Moleculaire formule TNT: C7H5N3O6
Moleculaire massa TNT: (7 * 12,01) + (5 * 1,008) + (3 * 14,01) + (6 * 16,00) = 84,07 + 5,04 + 42,03 + 96,00 = 227,14 gram per mol
Molaire massa O: 16,00 gram per mol
Molaire massa N: 14,01 gram per mol
6 zuurstofatomen in TNT, dus 96,00 gram O per mol TNT
3 stikstofatomen in TNT, dus 42,03 gram N per mol TNT
(96,00 / 227,14) * 100% = 42,26%
Het massa-aandeel van zuurstof in TNT is 42,26%
(42,03 / 227,14) * 100% = 18,50%
Het massa-aandeel van stikstof in TNT is 18,50%
Moleculaire massa TNT: (7 * 12,01) + (5 * 1,008) + (3 * 14,01) + (6 * 16,00) = 84,07 + 5,04 + 42,03 + 96,00 = 227,14 gram per mol
Molaire massa O: 16,00 gram per mol
Molaire massa N: 14,01 gram per mol
6 zuurstofatomen in TNT, dus 96,00 gram O per mol TNT
3 stikstofatomen in TNT, dus 42,03 gram N per mol TNT
(96,00 / 227,14) * 100% = 42,26%
Het massa-aandeel van zuurstof in TNT is 42,26%
(42,03 / 227,14) * 100% = 18,50%
Het massa-aandeel van stikstof in TNT is 18,50%
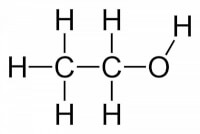 Figuur 3: ethanol / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)
Figuur 3: ethanol / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)Voorbeeld 3: Bier
Bier is een alcoholhoudend drankje en zeer populair onder jongeren en ouderen. Een normaal fles bier (330 mL) bevat 5 volume-% ethanol (figuur 3). Bereken het massa-percentage ethanol in bier. Neem hierbij aan dat bier slechts een oplossing is van ethanol in water.Deze opgaven zijn een stap moeilijker dan die in voorbeeld 1 of 2 vanwege de betrekking van een volumepercentage waarmee moet worden gerekend. Daarnaast bespreekt men een geheel molecuul (ethanol) in plaats van een enkel atoom binnen een molecuul. Bij dit soort vragen moeten de massadichtheden van de gevraagde stof aanwezig zijn. De berekening gaat als volgt: 5% van het volume is ethanol, dat houdt in dat het volume water 95% is van het totaalvolume. 95% van het volume moet dus worden omgerekend naar een massa met behulp van de dichtheid van water. Op dezelfde manier moet 5% van het volume omgerekend worden naar een massa met behulp van de dichtheid van ethanol. De massa ethanol wordt vervolgens gedeeld door de som van de massa's van het water en het ethanol, vermenigvuldigd met 100% en de uitkomst is het massa-aandeel van ethanol in bier.
5 volume-% is ethanol, dus 330 * 0,95 = 313,5 mL is water
330 * 0,05 (of 330 - 313,5) = 16,5 mL is ethanol
313,5 mL water met dichtheid 1,00 g/mL geeft 313,5 mL * 1,00 g/mL = 313,5 gram
16,5 mL ethanol met dichtheid 0,789 g/mL geeft 16,5 mL * 0,789 g/mL = 13,0185 gram
313,5 gram + 13,0185 gram = 326,5185 gram bier
(13,0185 / 326,5185) * 100 % = 3,99%
Het massa-aandeel van ethanol in bier is 3,99%
330 * 0,05 (of 330 - 313,5) = 16,5 mL is ethanol
313,5 mL water met dichtheid 1,00 g/mL geeft 313,5 mL * 1,00 g/mL = 313,5 gram
16,5 mL ethanol met dichtheid 0,789 g/mL geeft 16,5 mL * 0,789 g/mL = 13,0185 gram
313,5 gram + 13,0185 gram = 326,5185 gram bier
(13,0185 / 326,5185) * 100 % = 3,99%
Het massa-aandeel van ethanol in bier is 3,99%