Isomeren: de verschillende soorten
 Binnen de scheikunde komen veel isomeren voor. Isomeren zijn stoffen die hetzelfde aantal en dezelfde soorten atomen bevatten: hun molecuulformules zijn toch gelijk. Desondanks verschillen isomeren wel in hun structuurformules. Hierdoor kunnen isomeren, hoeveel ze vaak ook op elkaar lijken, toch verschillende fysische en chemische eigenschappen hebben.
Binnen de scheikunde komen veel isomeren voor. Isomeren zijn stoffen die hetzelfde aantal en dezelfde soorten atomen bevatten: hun molecuulformules zijn toch gelijk. Desondanks verschillen isomeren wel in hun structuurformules. Hierdoor kunnen isomeren, hoeveel ze vaak ook op elkaar lijken, toch verschillende fysische en chemische eigenschappen hebben.Structuurisomerie
Structuurisomeren zijn stoffen die hetzelfde aantal en hetzelfde soort atomen bevatten: hun molecuulformules zijn dus gelijk. Toch zitten er verschillen in de manier waarop de atomen met elkaar verbonden zijn. Structuurisomeren lijken vaak veel op elkaar als het gaat om fysische en chemische eigenschappen.Hieronder zie je twee mogelijke isomeren van pentanol. Zoals je ziet bestaan de moleculen uit exact dezelfde atomen; enkel de plaatsing van de OH-groep is bij de twee isomeren verschillend.
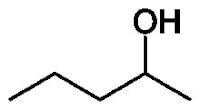 2-pentanol / Bron: Wikipedia
2-pentanol / Bron: Wikipedia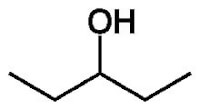 3-pentanol / Bron: Publiek domein, Wikimedia Commons (PD)
3-pentanol / Bron: Publiek domein, Wikimedia Commons (PD)Stereo-isomerie
Ook bij stereo-isomerie is er sprake van stoffen met hetzelfde aantal en dezelfde soort atomen. De manier waarop de atomen verbonden zijn is bij deze vorm van isomerie echter gelijk: het verschil zit hem in de ruimtelijke ordening en schikking van de atomen.Er bestaan verschillende vormen van stereo-isomerie. Twee belangrijke groepen zijn de cis-trans-isomeren en de optische isomeren.
Cis-trans-isomerie
Bij cis-trans-isomerie is er sprake van functionele groepen die aan weerszijden van een dubbele binding of een ringstructuur liggen. Het is mogelijk dat de functionele groepen allebei aan dezelfde kant zitten; in dit geval wordt er gesproken van en cis-configuratie. Wanneer de functionele groepen echter tegenover elkaar liggen, wordt er gesproken van een trans-configuratie. Cis-trans-isomeren hebben verschillende fysische eigenschappen.
In het linkerplaatje hieronder is te zien dat de twee chlooratomen zich allebei onder de dubbele binding bevinden. Hierbij is dus sprake van een cis-configuratie. In het plaatje rechts is te zien dat de chlooratomen zich allebei aan een andere kant van de binding liggen en zich dus ook tegenover elkaar bevinden: hier is dus sprake van een trans-configuratie.
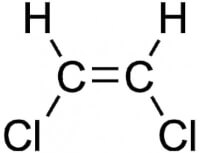 Cis-configuratie
Cis-configuratie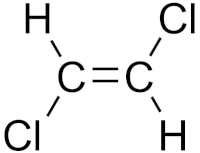 Trans-configuratie / Bron: Edgar181, Wikimedia Commons (Publiek domein)
Trans-configuratie / Bron: Edgar181, Wikimedia Commons (Publiek domein)Van optische isomerie is sprake als er een molecuul een asymmetrisch centrum bevat. In de meeste gevallen is dit een asymmetrisch koolstofatoom. In dit geval is er spraken van een koolstofatoom met vier verschillende zijgroepen.
Bij optische isomerie zijn deze vier zijgroepen hetzelfde, maar zijn ze anders gerangschikt: hoe je ze ook draait, je zult nooit twee identieke moleculen krijgen. Omdat stereo-isomeren meestal elkaars spiegelbeeld zijn, wordt optische isomerie ook vaak aangeduid als "spiegelbeeldisomerie". Optische isomeren lijken ontzettend op elkaar qua eigenschappen zoals kookpunt, smeltpunt, kleur en oplosbaarheid. Ze verschillen echter wel in polarisatie, de richting waarop trillingen van licht worden gedraaid. Dit is ook wel de reden dat deze vorm van isomerie "optische isomerie" wordt genoemd.
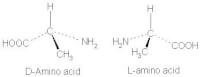 Deze stoffen zijn elkaars spiegelbeeld / Bron: Publiek domein, Wikimedia Commons (PD)
Deze stoffen zijn elkaars spiegelbeeld / Bron: Publiek domein, Wikimedia Commons (PD)