Wet van Nernst, chemische spanning toegelicht in Excel
 Een batterij is een klein stroom leverend fabriekje. De energie die bij de reactie in dat fabriekje wordt geproduceerd, komt vrij in de vorm van een elektronenstroom. De spanning van zo'n batterij loopt bij gebruik achteruit omdat de concentraties van de reagerende stoffen veranderen. De wet van Nernst geeft het verband tussen de elektrodepotentialen en de concentraties van de stoffen in de oplossing. Die afhankelijkheid laat zich simpel tonen in Excel.
Een batterij is een klein stroom leverend fabriekje. De energie die bij de reactie in dat fabriekje wordt geproduceerd, komt vrij in de vorm van een elektronenstroom. De spanning van zo'n batterij loopt bij gebruik achteruit omdat de concentraties van de reagerende stoffen veranderen. De wet van Nernst geeft het verband tussen de elektrodepotentialen en de concentraties van de stoffen in de oplossing. Die afhankelijkheid laat zich simpel tonen in Excel.- Elektrochemie
- Redoxreacties
- Redoxkoppels
- Voorspellen van redoxreacties
- Redoxreactie op afstand
- De wet van Nernst
- De elektrische cel ZnΙZn2+ΙΙCu2+ΙCu
- Wet van Nernst in Excel voor twee redoxkoppels
- De twee halfcellen
- Opmaak werkblad
- De grafiek invoegen
- Salpeterzuur als oxidator
- Potentiometrische titratie van zilver in Excel
- Vaardigheden in Excel
- Werkblad opmaken
Elektrochemie
De elektrochemie is dat deel van de scheikunde dat zich bezighoudt met processen waarbij elektronenoverdracht plaatsvindt.Redoxreacties
Bij een redoxreactie staat een reductor elektronen af aan een oxidator. Chemici schrijven zo'n reactie vaak in twee zogenaamde halfreacties op. Een reactie als Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) wordt opgeschreven als:- Halfreactie reductor: Zn(s) → Zn2+ + 2e-
- Halfreactie oxidator: Cu2+ + 2e- → Cu(s)
Redoxkoppels
Als een reductor elektronen afstaat, ontstaat een deeltje dat in principe weer elektronen kan opnemen. Anders gezegd: bij iedere reductor hoort een geconjugeerde oxidator en bij iedere oxidator hoort een geconjugeerde reductor. Zn/Zn2+ en Cu2+/Cu zijn twee voorbeelden van redoxkoppels.Voorspellen van redoxreacties
De overdracht van elektronen is op te vatten als een soort touwtrekwedstrijd tussen de oxidator van het ene koppel en de geconjugeerde oxidator van het andere koppel. Cu2+ is een sterkere oxidator dan Zn2+, zodat Cu2+ de elektronen kan wegtrekken bij Zn. Het feit dat Ag+ reageert met Cu, betekent dus dat Ag+ een sterkere oxidator is dan Cu2+. Hieruit kun je concluderen dat Ag+ ook met Zn zal reageren.Redoxreactie op afstand
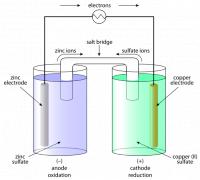
In een elektrische cel reageert een oxidator met een reductor waarbij de elektronen door een metaal worden geleid. De stroomkring wordt gesloten door een zoutbrug. Aan de elektroden vinden de halfreacties plaats. De schematische voorstelling van deze cel is:ZnΙZn2+ΙΙCu2+ΙCu
Als de polen geleidend met elkaar verbonden worden, stromen de elektronen van de zinkelektrode naar de koperelektrode. De zinkelektrode is negatief, de koperelektrode is positief. Er loopt een stroom zolang er een potentiaalverschil is tussen de twee elektrodes. Dit potentiaalverschil is afhankelijk van de concentraties van de oxidatoren en geconjugeerde reductoren in de oplossingen.
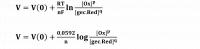 Wet van Nernst
Wet van NernstDe wet van Nernst
De wet van Nernst geeft het verband tussen de potentiaal en de concentraties van de deeltjes die in de halfreactie voorkomen. Als de concentraties 1 mol/L zijn, T=298 K, p=p0 en het potentiaalverschil wordt gemeten ten opzichte van de standaard waterstofelektrode spreekt men van de standaardelektrodepotentiaal V(0). Onder standaardomstandigheden wordt de term (RT/nF)ln() omgerekend 0,0592/n)log(). Merk op dat bij concentraties van 1 mol/L geldt V = V(0)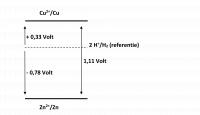 Berekening bronspanning elektrische cel
Berekening bronspanning elektrische celDe elektrische cel ZnΙZn2+ΙΙCu2+ΙCu
Voor beide halfreacties geldt dat n = 2. De coëfficiënten p en q zijn 1. Cu en Zn zijn vaste stoffen en worden niet opgenomen in de wet van Nernst (dat geldt overigens ook voor gassen). Stel [Cu2+] = 0,5 mol/L; [Zn2+] = 0,2 mol/L. De standaardelektrodepotentialen zijn: V(0) Cu2+/Cu = + 0,34 Volt en V(0) Zn2+/Zn = - 0,76 Volt.- (+) pool: Cu ⇄ Cu2+ + 2e-
- V(Cu2+/Cu) = + 0,34 + (0,0592/2)log(0,5) = + 0,33 Volt
- (-) pool: Zn ⇄ Zn2+ + 2e-
- V(Zn2+/Zn) = - 0,76 + (0,0592/2)log(0,2) = - 0,78 Volt
Het potentiaalverschil ΔV = + 0,33 - (-0,78) = 1,11 Volt
Wet van Nernst in Excel voor twee redoxkoppels
Er komen twee lijnen in één diagram, waarbij de concentraties variëren van 1.10-14 tot 2 mol/L. Het ene koppel is Cr/Cr3+ met een V(0) van - 0,74 Volt en het tweede koppel is Cd/Cd2+ met een V(0) van - 0,40 Volt.Om de grote verschillen in concentratie goed in beeld te brengen, wordt gebruik gemaakt van een logaritmische schaal. Dat levert rechte lijnen op waarvan de helling afhankelijk is van de waarde van n en de coëfficiënten p en q.De twee halfcellen
Halfcel I: Cr/Cr3+ met V = - 0,74 + (0,0592/3)log([Cr3+])Halfcel II: Cd/Cd2+ met V = - 0,40 + (0,0592/2)log([Cd2+])
 Opmaak werkblad Cr/Cr3+ en Cd/Cd2+
Opmaak werkblad Cr/Cr3+ en Cd/Cd2+Opmaak werkblad
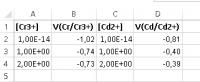
Type alleen de tekst over tussen de aanhalingstekens.[OLIST]Zet in cel A1 "[Cr3+]", in cel B1 "V(Cr/Cr3+)", in cel C1 '[Cd2+]", in cel D1 "V(Cd/Cd2+)"
Maak de koppen vet en passend
Selecteer de cellen A2, A3 en A4 en de cellen C2, C3 en C4 en maak ze op in de wetenschappelijke notatie door rechts te klikken op het geselecteerde gebied en in het menu te kiezen voor Celeigenschappen, Getal, Wetenschappelijk (twee decimalen)
Type in cel A2 en cel C2 "1E-14"
Type in cel A3 en Cel C3 "1" en in cel A4 en C4 "2"
Type in cel B2 "=-0,74+(0,059/3)*log(A2)"
Type in cel D2 "=-0,40+(0,059/2)*log(C2)"
Kopieer B2 naar B3 en B4 en kopieer D2 naar D3 en D4, maak de uitkomsten op als een getal met twee decimalen.[/OLIST]
De grafiek invoegen
Na het invoegen zijn er enkele aanpassingen nodig.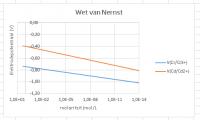 Wet van Nernst voor Cr/Cr3+ en Cd/Cd2+
Wet van Nernst voor Cr/Cr3+ en Cd/Cd2+Kies voor "Spreiding met vloeiende lijnen".
Klik rechts in het Tekengebied en kies voor "Gegevens selecteren"
Klik op toevoegen
Kies voor de "Reeksnaam" cel D1
Kies voor "Reeks X-waarden" de cellen C2 tot en met C4
Verwijder in "Reeks Y-waarden" wat er staat en kies voor de cellen D2 tot en met D4
Klik op OK en nogmaals op OK
Ga met de cursor over de horizontale as en klik rechts als het label "As Horizontaal (waarde)" op popt"
Kies voor "As opmaken"
Scroll in het menu "As opmaken" naar beneden en zet een vinkje bij "Logaritmische schaal" en "Waarden in omgekeerde volgorde"
Ga iets naar boven en zet "Verticale as snijdt bij" op "Automatisch"
Zet bij Notatie, Wetenschappelijk het aantal decimalen op 1
Zet bij Labels, de labelpositie op laag
Sluit het menu aan de zijkant en klik in het tekengebied
Klik op de plus en vink in het menu dat verschijnt de vakjes "Astitels", "Grafiektitel" en "Legenda" aan (negeer de eventuele foutmelding)
Wijzig het woord "Grafiektitel" in "Wet van Nernst"
Wijzig de horizontale astitel in "Molariteit (mol/L)"
Sleep de verticale astitel naar de linkerbovenkant van de grafiek en wijzig de astitel in "Elektrodepotentiaal (V)"[/OLIST]
 Geconcentreerd en verdund salpeterzuur als oxidator in Excel
Geconcentreerd en verdund salpeterzuur als oxidator in ExcelSalpeterzuur als oxidator
Geconcentreerd salpeterzuur is om en nabij 16 M; verdund salpeterzuur < 1 M. In de tabellen staan twee halfreacties voor salpeterzuur:- Verdund salpeterzuur: NO3- + 4 H+ + 3 e- ⇄ NO(g) + 2 H2O (V(0) = 0,96 Volt)
- Geconcentreerd salperterzuur: NO3- + 2 H+ + e- ⇄ NO2(g) + H2O (V(0) = 0,81 Volt)
De wet van Nernst voor beide halfreacties luidt:
- V(NO3-/NO) = + 0,96 + (0,0592/3)log([H+]4.[NO3-]
- V(NO3-/NO2) = + 0,81 + (0,0592/1)log([H+]2.[NO3-]
In het diagram is te zien dat (16 M) geconcentreerd salpeterzuur een sterkere oxidator is dan (1 M) verdund salpeterzuur, ondanks dat het onder standaardomstandigheden de zwakkere oxidator is.
Potentiometrische titratie van zilver in Excel
Bij het bepalen van het zilvergehalte wordt een klein deel van het zilver opgelost in geconcentreerd salpeterzuur. Na enige bewerkingen wordt de Ag+-houdende oplossing getitreerd met een NaCl-oplossing van nauwkeurig bekende molariteit, terwijl er een zilverelektrode in de oplossing staat. De reactie die optreedt is Ag+ + Cl- → AgCl(s). De potentiaal van de zilverelektrode wordt gemeten ten opzichte van een standaardelektrode. De verandering in de potentiaal laat nauwkeurig zien waar het equivalentiepunt ligt.Vaardigheden in Excel
Bij het opmaken van het werkblad wordt gebruik gemaakt van een aantal algemene vaardigheden:- Een reeks getallen invoeren
- Een formule invoeren met verwijzing naar een reeks cellen
- Relatieve en absolute verwijzingen
Bij het invoeren van de formules wordt daarnaast gebruik gemaakt van deze specifieke vaardigheden:
- De functies LOG() en WORTEL()
- De functie (ALS)
Werkblad opmaken
In het werkblad staan verwijzingen naar verschillende begingegevens met onder andere de standaardelektrodepotentiaal voor het koppel Ag+/Ag en het oplosbaarheidsprodukt van AgCl(s). Opmaak werkblad potentiometrische titratie van zilver
Opmaak werkblad potentiometrische titratie van zilverZet in cel E1 "M(NaCl)", in cel F1 "V(Ag+)", in cel G1 "M(Ag+)", in cel H1 "Ks(AgCl)", in cel I1 "V(0) Ag+/Ag" en in cel J1 "ep".
Zet in cel E2 "0,1", in cel F2 "25", in cel G2 "0,1", in cel H2 "1,56E-10", in cel I2 "0,80" en in cel J2 "=F2*G2/E2"
Vul A2 tot en met A102 vanaf 0 tot 50 met een interval van 0,5 en zet in B2
"=ALS(A2<$J$2;(25*$G$2-A2*$E$2)/(A2+$F$2);ALS(A2=$J$2;WORTEL($H$2);$H$2/(A2*$E$2-$F$2*$G$2)/(A2+$F$2)))"
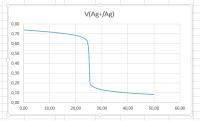 Titratiecurve potentiometrische titratie zilver
Titratiecurve potentiometrische titratie zilverKopieer B2 en C2 tot en met B102 en C102
Maak de koppen vet en passend
Zet de opmaak in de kolommen A, B en C op 2 decimalen en zet kolom B in de wetenschappelijke notatie
Selecteer kolom A en kolom C en kies voor INVOEGEN, Grafiek, Spreidings -(X,Y) of bellendiagram, Spreiding met vloeiende lijnen.[/OLIST]