Chemisch evenwicht toegelicht met grafieken in Excel
 Veel chemische reacties zijn omkeerbaar, afhankelijk van de omstandigheden verloopt de reactie of de ene kant op of de andere kant. Daarnaast is het mogelijk dat beide processen tegelijkertijd verlopen. In dat geval bevat het reactiemengsel na enige tijd meetbare hoeveelheden uitgangsstoffen en reactieproducten, waarvan de concentraties niet meer veranderen, er is sprake van een chemisch evenwicht. Met behulp van Excel kan inzichtelijk worden gemaakt hoe een chemisch evenwicht tot stand komt en op welke wijze het evenwicht kan worden beïnvloed door het veranderen van concentraties en het toevoegen van een katalysator. Grafieken van de reactiesnelheden en de concentraties tegen de tijd illustreren de instelling en de beïnvloeding van het evenwicht.
Veel chemische reacties zijn omkeerbaar, afhankelijk van de omstandigheden verloopt de reactie of de ene kant op of de andere kant. Daarnaast is het mogelijk dat beide processen tegelijkertijd verlopen. In dat geval bevat het reactiemengsel na enige tijd meetbare hoeveelheden uitgangsstoffen en reactieproducten, waarvan de concentraties niet meer veranderen, er is sprake van een chemisch evenwicht. Met behulp van Excel kan inzichtelijk worden gemaakt hoe een chemisch evenwicht tot stand komt en op welke wijze het evenwicht kan worden beïnvloed door het veranderen van concentraties en het toevoegen van een katalysator. Grafieken van de reactiesnelheden en de concentraties tegen de tijd illustreren de instelling en de beïnvloeding van het evenwicht.- Chemische achtergrond
- Instelling van het evenwicht
- Statische en dynamisch evenwichten
- Ligging van het evenwicht
- Chemisch evenwicht in Excel
- Vaardigheden in Excel
- Opmaak van het werkblad
- De koppen van het werkblad
- Waarden en formules van het werkblad
- De invloed van veranderingen in A of B op de ligging van het evenwicht
- De grafieken op het werkblad zetten
- Gebruik van het werkblad
- De snelheden van de reacties
- Beginconcentraties en evenwichtsconcentraties
- Invloed van een katalysator
- Invloed A of B toevoegen terwijl er evenwicht is
Chemische achtergrond
Een chemisch evenwicht ontstaat als bij een omkeerbare reactie beide reacties tegelijkertijd optreden. Dat is bijvoorbeeld het geval bij de ontleding van water in waterstof en zuurstof tussen 1000 en 2000 graden Celsius. 2 H2O(g) ⇄ 2 H2(g) + O2(g).Instelling van het evenwicht
Als water in een gesloten vat met een temperatuur van 1500 graden wordt gebracht, zal de ontledingsreactie starten. De snelheid van deze ontleding is maximaal omdat op dat moment de concentratie van het water het grootst is. Zodra de eerste waterstof en zuurstof is gevormd, begint de reactie waarbij weer water wordt gevormd. De snelheid van de vorming van water is op dat moment zeer klein omdat de concentraties van waterstof en zuurstof heel klein zijn. Gedurende het proces neemt de concentratie van water af en daarmee de snelheid van de ontleding van water, en nemen de concentraties van waterstof en zuurstof toe en daarmee de snelheid van de vorming van water. Dit gaat net zo lang door tot de snelheden aan elkaar gelijk zijn. De hoeveelheid water die ontleedt, is precies gelijk aan de hoeveelheid water die wordt gevormd. Hetzelfde geldt voor de hoeveelheden waterstof en zuurstof die worden gevormd en weggenomen. Op dat moment zullen de concentraties van de stoffen niet meer veranderen, er is sprake van chemisch evenwicht. De tijd die verstrijkt totdat het evenwicht wordt bereikt, wordt de insteltijd van het evenwicht genoemd.Statische en dynamisch evenwichten
Bij een statisch evenwicht is er sprake van tegengestelde grootheden die elkaar opheffen. Zo drijft een dobber in het water omdat de naar beneden gerichte zwaartekracht wordt gecompenseerd door de naar bovengerichte opwaartse kracht van het water. Een chemisch evenwicht is een voorbeeld van een dynamisch evenwicht, dat wil zeggen dat er van alles gebeurt, maar dat het nettoresultaat 0 is. Tegengestelde processen zorgen voor een situatie die van buitenaf gezien niet verandert. De concentraties van de uitgangsstoffen en reactieproducten hoeven niet aan elkaar gelijk te zijn (dat is meestal ook niet het geval). Neem het voorbeeld van een grote stad waar op een zeker moment van de dag evenveel auto's in als uit rijden. Het aantal auto's binnen en buiten de stad verandert op dat moment niet. Het is een dynamisch evenwicht omdat de processen van het in en uit rijden gewoon doorgaan. Niemand zal beweren dat het aantal auto's in de stad even groot is als buiten de stad.Ligging van het evenwicht
Bij een omkeerbare reactie kunnen zich na de instelling van het evenwicht verschillende situaties voordoen:- De reactie is aflopend naar rechts: er zijn geen meetbare hoeveelheden meer van (één van) de uitgangsstoffen.
- De reactie verloopt niet: er zijn geen meetbare hoeveelheden van de reactieproducten.
- Het evenwicht ligt links: de concentraties van de uitgangsstoffen zijn groter dan die van de reactieproducten.
- Het evenwicht ligt rechts: de concentraties van de reactieproducten zijn groter dan die van de uitgangsstoffen.
Chemisch evenwicht in Excel
Er wordt een document gemaakt met twee grafieken (reactiesnelheid-tijd en concentratie-tijd) die de instelling van een evenwicht tonen. Daarnaast wordt het mogelijk verstoringen van het evenwicht te laten zien.Vaardigheden in Excel
Bij het maken van grafieken in Excel wordt gebruik gemaakt van een aantal algemene vaardigheden:[OLIST]Een reeks getallen invoeren
Een formule invoeren met verwijzing naar een reeks cellen
Grafieken invoegen op het werkblad
Grafieken aanpassen
Relatieve en absolute verwijzingen[/OLIST]
Bij het maken van de evenwichtsdiagrammen wordt daarnaast gebruik gemaakt van deze specifieke vaardigheden:
[OLIST]Gegevensvalidatie
De functie (ALS)[/OLIST]
Opmaak van het werkblad
Het werkblad wordt zo opgemaakt, dat variabelen als beginconcentratie, reactieconstanten, de aanwezigheid van een katalysator en de concentratie in de evenwichtstoestand kunnen worden aangepast. Neem de aanhalingstekens niet over.De koppen van het werkblad
[OLIST]Zet in cel A1, B1 en C1 respectievelijk "tijd", "s1" en "s2"Zet in cel E1 en F1 respectievelijk "[A]" en "[B]"
Zet in cel H1 en I1 respectievelijk "[A]0" en "[B]0"
Zet in cel J1, K1, L1, M1 en N1 respectievelijk "invoer k1", "invoer k2", "k1","k2" en "katalysator"
Zet in cel P1 en Q1 respectievelijk "[A] ev." en "[B] ev."
Zet in cel S1, T1 en U1 respectievelijk "Verstoren", "Verander [A]" en "Verander [B]"
Maak de koppen vet en waar nodig passend
[/OLIST]



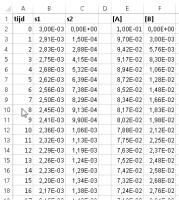
Waarden en formules van het werkblad
Er wordt gewerkt met de het evenwicht A(g) ⇄ B(g), met [A]0 is 0,1 mol/L en [B]0 = 0 mol/L.[OLIST]Vul kolom A van A2 tot en met A202 met de waarden 0 tot en met 200 met interval 1
Zet in B2 "=$L$2*E2" en in C2 "=$M$2*F2"
Kopieer deze formules naar beneden tot en met B202 en C202
Zet in E2 "=H2" en in F2 "=I2"
Zet in E3 "=E2-$L$2*E2+$M$2*F2" en in F3 "=F2+$L$2*E2-$M$2*F2"
Kopieer deze formules naar beneden tot en met E202 en F202
Voer in H2 en I2 respectievelijk de waarden "0,1" en "0" in
Voer in J2 en K2 respectievelijk de waarden "0,03" en "0,05" in
Voer in L2 en M2 respectievelijk de formules "=J2*N2" en "=K2*N2" in
Voer in N2 de waarde "1" in en kies, terwijl de cursor in N2 staat bij GEGEVENS voor "Gegevensvalidatie"
Kies bij "Instellingen" voor Decimaal tussen "0,1" en "10" en type bij Invoerbericht, "Titel" de tekst "Invloed katalysator" en bij "Invoerbericht" de tekst "1 = geen katalysator[ENTER] 0,1<getal<10" en klik daarna op OK
Voer in P2 en Q2 respectievelijk de formules "=WAARDE(E202)" en "=WAARDE(F202)" in
Voer in S2 de waarde "0" in en kies, terwijl de cursor in S2 staat bij GEGEVENS voor "Gegevensvalidatie"
Kies bij "Instellingen" voor geheel getal tussen "0" en "2" en type bij Invoerbericht, "Titel" de tekst "Evenwicht verstoren" en bij "Invoerbericht" de tekst "Geen verstoring: 0"[ENTER]"Verstoring: 1"ENTER]"In cel T2 toevoegen of weghalen A"[ENTER]"Verstoring: 2"[ENTER]"In cel U2 toevoegen of weghalen B" en klik daarna op OK
Zet in T2 en U2 respectievelijk "0,1" en "0,1"
Schakel bij T2 en U2 gegevensvalidatie in met Instelling "Decimalen", Minimum "0" en Maximum "100"; Invoerbericht "Waarde >0"
Maak de kolommen B, C, E en F op in de wetenschappelijke notatie met 2 decimalen (selecteren, rechts klikken, Celeigenschappen, Getal, Wetenschappelijk)
Maak P2 en Q2 op als een getal met drie decimalen en S2 als een getal met nul decimalen.
Maak H2 tot en met N2 en T2 en U2 op als een getal met twee decimalen[/OLIST]
De invloed van veranderingen in A of B op de ligging van het evenwicht
Er wordt uitgegaan van een evenwichtssituatie bij t = 100. Al naar gelang de waarde van S2 wordt gerekend met de formule die er eerst stond of er wordt een nieuw concentratie A of B gebruikt.[OLIST]Zet de cursor in cel E102 en verander de inhoud in "=ALS(OF(S2=0;S2=2);E101-$L$2*E101+$M$2*F101;T2)"
Zet de cursor in cel F102 en verander de inhoud in "=ALS(OF(S2=0;S2=1);F101+$L$2*E101-$M$2*F101;U2)"[/OLIST]
De grafieken op het werkblad zetten
Er komen twee grafieken naast elkaar: reactiesnelheden tegen de tijd en de concentraties tegen de tijd.[OLIST]Selecteer cel A1 tot en met C202 en scroll naar boven
Kies voor INVOEGEN, Grafieken, Spreidings-(X,Y) of bellendiagram invoegen, Spreiding met vloeiende lijnen
Sleep dit diagram zover mogelijk naar links
Selecteer A1 tot en met A202 en E1F1 tot en met E202F202 en voeg dit diagram met Spreiding met vloeiende lijnen in.
Zet de twee diagrammen netjes naast elkaar.
Ga met de cursor over de horizontale assen tot "As: Horizontaal (waarde)" zichtbaar wordt. Klik rechts en kies voor as opmaken
Zet het maximum voor beide horizontale assen op 200
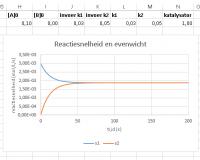
Geef de linkergrafiek de Titel "Reactiesnelheid en evenwicht" en de rechter "Concentratie en evenwicht"
Klik ergens in het grafiekgebied en daarna op de plus aan de rechterkant, zet een vinkje bij astitels. Voor beide grafieken.
Geef de horizontale assen de astitel "tijd (s)"
Geef in de linkergrafiek de verticale as de titel "reactiesnelheid (mol/L/s)" en rechts "concentratie (mol/L"
Sla het document op als "Chemische Evenwichten.xlsx"[/OLIST]
Gebruik van het werkblad
Het document Chemische Evenwichten.xlsx kan worden gedownload en geopend in Excel.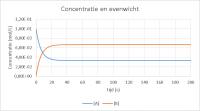 Het evenwicht ligt rechts
Het evenwicht ligt rechtsDe snelheden van de reacties
De evenwichtsconstante K van een evenwicht is uitsluitend afhankelijk van de temperatuur. Er geldt K = k1/k2. Als k1 groter is dan k2 ligt het evenwicht rechts, dat wil in dit geval zeggen [B] > [A]. Om dit zichtbaar te maken: voer in J2 "0,1" in.![[B]<SUB>0</SUB> = 1,0 mol/L](/artikel-fotos/3s4u/843492976264-thumb1.jpg) [B]0 = 1,0 mol/L
[B]0 = 1,0 mol/LBeginconcentraties en evenwichtsconcentraties
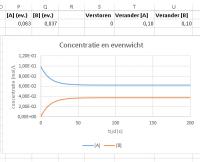
Zet J2 weer op "0". In de oorspronkelijke grafiek is te zien dat [A] verandert van 1,0.10-1 naar 6,25.10-2 mol/L. Dat betekent dat er 3,75.10-2 mol A per Liter is omgezet in evenveel B. Dit is te zien in cellen P2 en Q2 of door met de cursor over de lijnen te gaan.Verander de waarde van I2 in "1". De reactie verloopt met deze nieuwe beginconcentratie van B nu naar links tot het evenwicht zich heeft ingesteld. Uit de beginconcentratie en de evenwichtsconcentratie van B is de evenwichtsconcentratie van A te berekenen.
Invloed van een katalysator
Zet I2 weer op "0". Een katalysator beïnvloedt beide reactiesnelheden in gelijke mate. Dat betekent dat de insteltijd van het evenwicht korter wordt, maar dat de concentraties in de evenwichtstoestand niet anders zijn. In cel N2 kan de rol van de katalysator worden ingesteld. De waarde 1 betekent geen katalysator, de waarde > 1 een versnelling en de waarde < 1 een vertraging. Geef N2 achtereenvolgens de waarden 2, 5 en 0,5 en kijk wat er gebeurt.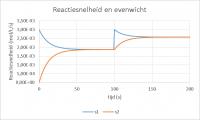 Verandering reactiesnelheden na toevoegen 0,1 mol A
Verandering reactiesnelheden na toevoegen 0,1 mol AInvloed A of B toevoegen terwijl er evenwicht is
Zet N2 weer op "1". Als de waarde van S2 ongelijk is aan 0, wordt het evenwicht verstoord door het voegen van A (S2=1) of B (S2=2). Met S2 op 1 veranderen de grafieken vanaf t=100. De reactiesnelheid naar rechts neemt in eerste instantie toe, terwijl die naar links nog 0 is. Daarna lopen beide reactiesnelheden weer naar elkaar toe, waarbij de concentratie van A is toegenomen en die van B eveneens. Verandering concentraties na toevoegen 0,1 mol A
Verandering concentraties na toevoegen 0,1 mol A