De chemie van het wassen met water en zeep
 Bij het wassen komen verschillende scheikundige principes mooi bij elkaar. De moderne wasmachine is de automatisering van de oude tobbe met het wasbord. De drie ingrediënten van het wasproces zijn beweging, water en zeep. De beweging is nodig om het vuil los te maken, het water om het vuil af te voeren en de zeep om het vuil in het water te krijgen en te houden. Aan het moderne wasmiddel zijn allerlei stoffen toegevoegd om het wasproces bij lagere temperatuur en met synthetische producten te kunnen uitvoeren, maar het principe is nog steeds zoals bij de ouderwetse groene of gele zeep.
Bij het wassen komen verschillende scheikundige principes mooi bij elkaar. De moderne wasmachine is de automatisering van de oude tobbe met het wasbord. De drie ingrediënten van het wasproces zijn beweging, water en zeep. De beweging is nodig om het vuil los te maken, het water om het vuil af te voeren en de zeep om het vuil in het water te krijgen en te houden. Aan het moderne wasmiddel zijn allerlei stoffen toegevoegd om het wasproces bij lagere temperatuur en met synthetische producten te kunnen uitvoeren, maar het principe is nog steeds zoals bij de ouderwetse groene of gele zeep.- De vragen vooraf
- Waarom lossen stoffen wel of niet op in water?
- Krachten tussen deeltjes
- Vuistregel voor het oplossen
- Wat is een emulsie?
- Wat is oppervlaktespanning?
- Wassen met zeep
- De moleculaire structuur van zeep
- De effecten van zeep
- De chemie van het wassen
- Aan zeep toegevoegde stoffen
De vragen vooraf
Wat moet je weten om de chemie van het wasproces te begrijpen?- Waarom lossen stoffen wel of niet op in water?
- Wat is een emulsie?
- Wat is oppervlaktespanning?
Waarom lossen stoffen wel of niet op in water?
Krachten tussen deeltjes
Bij het oplossen heb je te maken met de krachten tussen de deeltjes van de stof die je wil oplossen, de krachten tussen de deeltjes van het oplosmiddel en de krachten tussen deze deeltjes onderling. Deze krachten zijn afhankelijk van het bindingstype dat in de stof voorkomt. De bouwsteentjes van een stof bestaan uit moleculen, atomen of ionen: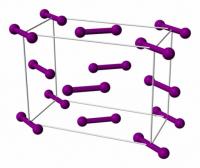 Molecuulrooster van jood / Bron: Ben Mills, Wikimedia Commons (Publiek domein)
Molecuulrooster van jood / Bron: Ben Mills, Wikimedia Commons (Publiek domein)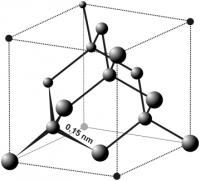 Atoomrooster van diamant / Bron: Anton, Wikimedia Commons (CC BY-SA-3.0)
Atoomrooster van diamant / Bron: Anton, Wikimedia Commons (CC BY-SA-3.0)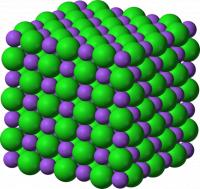 Ionrooster van keukenzout / Bron: Benjah-bmm27, Wikimedia Commons (Publiek domein)
Ionrooster van keukenzout / Bron: Benjah-bmm27, Wikimedia Commons (Publiek domein)- In het molecuulrooster zijn de bouwsteentjes van de stof de moleculen. Deze moleculen worden bij elkaar gehouden door de zwakke vanderwaalskracht. De binding tussen de atomen die samen het molecuul vormen heet de atoombinding.
- In het atoomrooster zijn de bouwsteentjes van de stof de atomen. Deze atomen worden bij elkaar gehouden door de sterke atoombinding.
- In het ionrooster zijn de bouwsteentjes van de stof de ionen, positief of negatief geladen atomen of atoomgroepen. Deze ionen worden bij elkaar gehouden door de sterke ionbinding.
De vanderwaalsbinding wordt in een aantal gevallen versterkt doordat moleculen een polair karakter hebben. Dit wordt veroorzaakt door het feit dat verschillende atoomsoorten een verschillende aantrekkingskracht uitoefenen op de elektronen die de atoombinding vormen. Door verschuiving van de elektronen in de richting van het atoom met de grootste aantrekkingskracht, de polaire atoombinding, ontstaat een ladingsverdeling binnen het molecuul. Als het zwaartepunt van de positieve lading en de negatieve lading in het molecuul niet samenvalt, heeft het molecuul een positieve en een negatieve kant. Een dergelijke deeltje wordt een dipool genoemd. De positieve kant van het ene molecuul trekt de negatieve kant van andere moleculen aan. Deze kracht is veel kleiner dan de ionbinding (een paar procent daarvan), maar groter dan de vanderwaalsbinding.



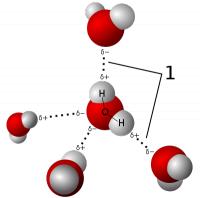 Bron: Qwerter, Wikimedia Commons (CC BY-SA-3.0)
Bron: Qwerter, Wikimedia Commons (CC BY-SA-3.0)Opmerking: de waterstofbruggen in water verklaren onder andere het extreem hoge smeltpunt en kookpunt van water (zonder waterstofbruggen zouden deze ruim onder de -150 graden Celsius liggen) en het uitzetten van water bij bevriezing (de vorming van waterstofbruggen zorgt voor een meer ruimtelijke structuur).
Vuistregel voor het oplossen
De regel wordt kort verwoord in de uitdrukking "soort zoekt soort". Beschouw de volgende mogelijkheden:- Zowel de krachten tussen de deeltjes van het oplosmiddel als de krachten tussen de deeltjes van de op te lossen stof zijn zwak. De krachten vormen geen belemmering voor het door elkaar bewegen van de verschillende moleculen. De stoffen mengen uitstekend. (Voorbeeld: vet lost prima op in wasbenzine)
- De krachten tussen de deeltjes van het oplosmiddel zijn sterk en de krachten tussen de deeltjes van de op te lossen stof zijn zwak. De krachten tussen de deeltjes van het oplosmiddel en die van de op te lossen stof zijn zwak. De stoffen mengen nauwelijks. (Voorbeeld: vet lost niet op in water)
- De krachten tussen de deeltjes van het oplosmiddel zijn zwak en de krachten tussen de deeltjes van de op te lossen stof zijn sterk. De krachten tussen de deeltjes van het oplosmiddel en die van de op te lossen stof zijn zwak. De stoffen mengen nauwelijks (Voorbeeld: keukenzout lost niet op in wasbenzine)
- Zowel de krachten tussen de deeltjes van het oplosmiddel als de krachten tussen de deeltjes van de op te lossen stof zijn sterk. De krachten tussen de deeltjes van het oplosmiddel en die van de op te lossen stof zijn eveneens sterk. In veel gevallen kunnen de deeltjes van het oplosmiddel de deeltjes van de op te lossen stof "uit het rooster trekken". De stoffen mengen goed. (Voorbeeld: keukenzout lost prima op in water)
Soort zoekt soort betekent dus dat apolaire stoffen in het algemeen goed oplossen in apolaire oplosmiddelen en polaire stoffen in polaire oplosmiddelen. Het mengen van polaire stoffen met apolaire stoffen lukt in de regel niet.
Wat is een emulsie?
 Bron: SuperManu / ZanderZ, Wikimedia Commons (CC BY-SA-3.0)
Bron: SuperManu / ZanderZ, Wikimedia Commons (CC BY-SA-3.0)Een emulgator is een oppervlakte-actieve stof. Dat wil zeggen dat de moleculen zich verzamelen aan het grensvlak van stoffen in een mengsel. Het gaat om moleculen met een polaire (hydrofiele) en een apolaire (hydrofobe) kant. Bij de bereiding van mayonaise worden de olie en het water flink door elkaar geklopt, waardoor de olie zich in fijne druppeltjes over het water verdeelt. De emulgator, bijvoorbeeld de stof die zich in eigeel bevindt, komt aan het oppervlak van deze druppeltjes terecht, waarbij de polaire kant in het water komt en de apolaire kant in het druppeltje. Deze laag om het druppeltje voorkomt dat de oliedruppeltjes weer samenvloeien.
Wat is oppervlaktespanning?
Het schaatsenrijdertje dat op het water loopt, een munt die in het wateroppervlak hangt, een druppel op een blad: het zijn allemaal voorbeelden van situaties waarbij de oppervlaktespanning een rol speelt. Bron: ISAKA Yoji (cory), Wikimedia Commons (CC BY-SA-2.1)
Bron: ISAKA Yoji (cory), Wikimedia Commons (CC BY-SA-2.1) Bron: Roger McLassus, Wikimedia Commons (CC BY-SA-3.0)
Bron: Roger McLassus, Wikimedia Commons (CC BY-SA-3.0)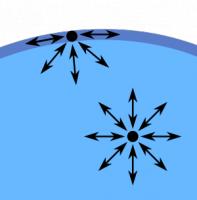 Bron: F?siahh, Wikimedia Commons (Publiek domein)
Bron: F?siahh, Wikimedia Commons (Publiek domein)- De moleculen aan het oppervlak vormen een veerkrachtige laag waar je doorheen moet prikken om onder het vloeistofoppervlak te komen. Lichte voorwerpen met een dichtheid die groter is dan water zinken toch niet omdat ze in het laagje blijven "hangen".
- Vloeistoffen neigen tot druppelvorming. De oppervlaktespanning dwingt een losse hoeveelheid vloeistof tot het vormen van een bol, die door de zwaartekracht iets van vorm verandert. In gewichtloze toestand heeft deze druppel de ideale bolvorm.
Wassen met zeep
 Bron: David C Todd, Wikimedia Commons (CC BY-SA-4.0)
Bron: David C Todd, Wikimedia Commons (CC BY-SA-4.0)De moleculaire structuur van zeep
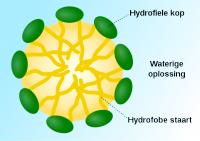
Zeep werd in het verleden gemaakt door dierlijk of plantaardig vet te verhitten met loog. Na toevoegen van grote hoeveelheden zout kwam de zeep boven drijven, waarna de vaste stof kon worden afgeschept. Een voorbeeld van een dergelijke zeep is de stof natriumstearaat, Na(C17H35COO). Als deze stof in water wordt gebracht komen er natrium- en stearaationen in de vloeistof. Het stearaation bestaat uit een lange apolaire staart van koolstof- en waterstofatomen met een kleine negatief geladen kop: Bron: NEUROtiker, Wikimedia Commons (Publiek domein)
Bron: NEUROtiker, Wikimedia Commons (Publiek domein)De effecten van zeep
 Bron: Wikik?ntscher, Wikimedia Commons (CC BY-SA-3.0)
Bron: Wikik?ntscher, Wikimedia Commons (CC BY-SA-3.0)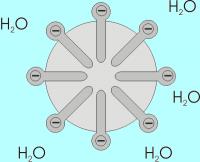 Bron: Anderl / Roland.chem , Wikimedia Commons (CC BY-SA-3.0)
Bron: Anderl / Roland.chem , Wikimedia Commons (CC BY-SA-3.0)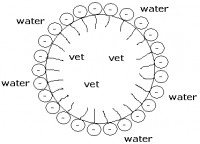 Bron: Klaas1978, Wikimedia Commons (CC BY-SA-3.0)
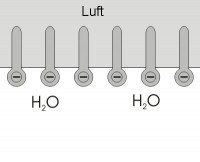
Bron: Klaas1978, Wikimedia Commons (CC BY-SA-3.0)Door de lange apolaire staart moeten er veel te veel waterstofbruggen in het water worden verbroken om losse stearaationen in het water te krijgen. Een deel van de steraationen komt aan het vloeistofoppervlak te zitten. De rest verenigt zich binnen het water tot kleine bolletjes waarbij de apolaire staarten naar binnen steken en daarmee hun eigen apolaire milieu vormen terwijl de geladen koppen in het water steken (soort zoekt soort). Een dergelijk deeltje heet een micel.
De chemie van het wassen
- De stearaationen aan het wateroppervlak verlagen de oppervlaktespanning drastisch, waardoor de druppelvorming wordt tegengegaan. Het water dringt daardoor in de vezels en kan het daarin aanwezige vuil bereiken. Het is nu ook makkelijk om door te kloppen een fijne verdeling van luchtbelletjes in water te maken (schuim).
- De micellen vormen een voorraadje van stearaationen die als ze in aanraking komen met apolair vuil, dit vuil kunnen omringen (apolaire staart in het vuil, polaire kop in het water) waardoor het vuil zwevend wordt gehouden en kan worden weggespoeld.
 Bron: Andreas Dries, Wikimedia Commons (Publiek domein)
Bron: Andreas Dries, Wikimedia Commons (Publiek domein)