Lewisstructuren, resonantiestructuren en aromaticiteit
Elektronen zijn in natuurwetenschappelijke fenomenen betrokken bij allerlei zaken. Het verplaatsen van een elektron van punt A naar punt B, bijvoorbeeld, is gelijk aan het hebben van een elektrische stroom. Het verplaatsen van een elektron van atoom A naar ion B is een voorbeeld van een redoxreactie. Elektronen kunnen ook stilstaan op een molecuul of ion, wat tekenend is voor de reactiviteit en chemische eigenschappen daarvan. Om deze elektronen aan te geven tekent men Lewisstructuren.Functie van Lewisstructuren
Lewisstructuren en covalente verbindingen werden beschreven door Gilbert Newton Lewis in 1916. Door zijn bevindingen kon men, aan de hand van de theorie die hij beschreef, Lewisstructuren opstellen voor een gegeven molecuul. Het opstellen van een Lewisstructuur geeft veel inzicht in bepaalde chemische eigenschappen van een molecuul, atoom of ion. Zo kan, aan de hand van een Lewisstructuur, een reactiemechanisme worden opgesteld, of de reactiviteit van een molecuul bepaald worden. Tevens zijn Lewisstructuren ook handig om resonantiestructuren op te stellen. Resonantiestructuren zijn moleculen met dezelfde molecuulformule, maar met een andere elektronenverdeling.Opstellen van Lewisstructuren
Het opstellen van Lewisstructuren is een redelijk eenvoudige taak. Een Lewisstructuur kan namelijk opgesteld worden uit de volgende informatie:- De hoeveelheid elektronen in de buitenste schil van een atoom
- De lading van een ion
Deze informatie is nodig omdat deze inzicht geeft in de hoeveelheid elektronen die zich bevinden in dit molecuul. Tevens kan deze informatie worden gebruikt om resonantiestructuren op te stellen. In de praktijk geldt dat moleculen met meerdere resonantiestructuren zeer stabiel zijn, en dus moeilijk afbreken. Dit komt omdat een gegeven molecuul een negatieve lading beter kan verspreiden over het gehele molecuul, waardoor de potentiële energie over het molecuul wordt verlaagd. Kort samengevat betekent dit dus dat de stabiliteit van een molecuul sterk gelinkt is aan de hoeveelheid resonantiestructuren die mogelijk zijn.
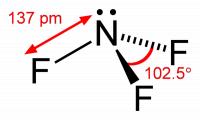 Figuur 1: stikstoftrifluoride. De elektronparen die de fluoratomen omringen zijn hier niet afgebeeld / Bron: Benjah-bmm27, Wikimedia Commons (Publiek domein)
Figuur 1: stikstoftrifluoride. De elektronparen die de fluoratomen omringen zijn hier niet afgebeeld / Bron: Benjah-bmm27, Wikimedia Commons (Publiek domein)Om Lewisstructuren op te stellen is het handig om een periodieke tabel te gebruiken. Hieruit kan de benodigde informatie worden gehaald. Uit de periodieke tabel kan men bijvoorbeeld achterhalen dat in het molecuul NF3 stikstof 5 elektronen in de buitenste schil heeft, en fluor 7. Met de kennis dat elk atoom 8 elektronen in de buitenste schil wil hebben (de octetregel), kan het volgende worden afgeleid:
- Fluor heeft 7 elektronen in de buitenste schil. Gezien er drie fluoratomen aanwezig zijn, is dit gelijk aan 3 * 7 = 21 elektronen
- Stikstof heeft 5 elektronen in de buitenste schil. Gezien er één stikstofatoom aanwezig is, is dit gelijk aan 5 * 1 = 5 elektronen
- Het totaal aantal elektronen in de buitenste schil van NF3 is zodoende 21 + 5 = 26 elektronen
- Rekening houdend met de octetregel wil stikstof nog 8 - 5 = 3 elektronen, en de drie fluoratomen nog 3 (8 - 7) = 3 elektronen
- Dit betekent dat 3 + 3 = 6 elektronen betrokken zijn bij een binding, dit is gelijk aan 3 elektronparen
- Dit betekent ook dat 26 - 6 = 20 elektronen niet-bindend zijn, oftewel 10 elektronparen
- Ergo, in NF3 bevinden zich 3 bindende elektronparen en 10 niet-bindende elektronparen
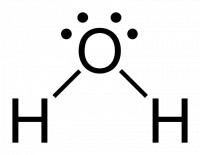 Figuur 2: Lewisstructuur voor water / Bron: Publiek domein, Wikimedia Commons (PD)
Figuur 2: Lewisstructuur voor water / Bron: Publiek domein, Wikimedia Commons (PD)Hier heeft men te maken met twee waterstofatomen en een zuurstofatoom. Voor waterstofatomen (H2), en tevens helium (He) geldt de aangepaste octetregel: deze atomen zijn stabiel wanneer deze omringd zijn met twee elektronen in plaats van acht. Ergo, als we hetzelfde toepassen voor water als voor stikstoftrifluoride, dan is dit de beredenering:
- Waterstof heeft 1 elektron in de buitenste schil. Gezien er twee waterstofatomen aanwezig zijn, is dit gelijk aan 2 * 1 = 2 elektronen
- Zuurstof heeft 6 elektronen in de buitenste schil. Gezien er één zuurstofatoom aanwezig is, is dit gelijk aan 1 * 6 = 6 elektronen
- Het totaal aantal elektronen in de buitenste schil van H2O is dus 2 + 6 = 8 elektronen
- Rekening houdend met de octetregel wilt zuurstof nog 8 - 6 = 2 elektronen, en de twee waterstofatomen nog 2 (2 - 1) = 2 elektronen
- Dit betekent dat 2 + 2 = 4 elektronen betrokken zijn bij de binding, dit is gelijk aan 2 elektronparen
- Dit betekent ook dat 8 - 4 = 4 elektronen niet betrokken zijn bij de binding, dit is gelijk aan 2 elektronparen
- Omdat waterstof al voldoet aan de octetregel voor waterstof zullen de niet-bindende elektronen zich bevinden op het zuurstof, zoals afgebeeld in figuur 2
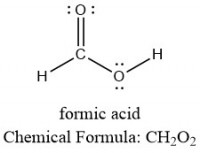 Figuur 3: methaanzuur, ook wel bekend als mierenzuur (formic acid)
Figuur 3: methaanzuur, ook wel bekend als mierenzuur (formic acid)Methaanzuur, ook mierenzuur genoemd, bestaat uit een centraal koolstofatoom waaraan een waterstofatoom, een zuurstofatoom en een hydroxylgroep aan zit verbonden. Ook hier kan dezelfde redenering worden toegepast:
- Koolstof heeft 4 elektronen in de buitenste schil. Omdat er één koolstofatoom is, is dit gelijk aan 1 * 4 = 4 elektronen
- Zuurstof heeft 6 elektronen in de buitenste schil. Omdat er twee zuurstofatomen zijn, is dit gelijk aan 2 * 6 = 12 elektronen
- Waterstof heeft 1 elektron in de buitenste schil. Omdat er twee waterstofatomen zijn, is dit gelijk aan 2 * 1 = 2 elektronen
- Het totaal aantal elektronen in de buitenste schil van methaanzuur is dus 4 + 12 + 2 = 18 elektronen.
- Rekening houdend met de octetregel willen de twee waterstofatomen 2 (2 - 1) = 2 elektronen, de twee zuurstofatomen 2 (8 - 6) = 4 elektronen en het koolstofatoom nog 8 - 4 = 4 elektronen
- Dit betekent dat 2 + 4 + 4 = 10 elektronen betrokken zijn bij een binding, dit is gelijk aan 5 elektronparen
- Dit betekent ook dat 18 - 10 = 8 elektronen niet betrokken zijn bij een binding, dit is gelijk aan 4 elektronparen
- De 5 bindende elektronparen zullen zodoende de C-H (1 paar), C=O (2 paar), C-OH (1 paar) en O-H (1 paar) zijn
- De niet-bindende elektronparen zullen zich zodoende op de zuurstofatomen bevinden, zoals afgebeeld in figuur 3
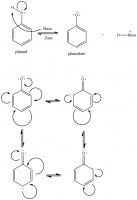 Figuur 4: Deprotonatie en resonantie van het fenolaat anion. In tegenstelling tot normaal benzeen heeft het fenolaat 4 resonantiestructuren
Figuur 4: Deprotonatie en resonantie van het fenolaat anion. In tegenstelling tot normaal benzeen heeft het fenolaat 4 resonantiestructurenResonantiestructuren
Met Lewisstructuren kunnen resonantiestructuren worden opgesteld. Als voorbeeld is fenol (IUPAC: benzenol) te beschouwen. Fenol bestaat uit een benzeenring met, op een willekeurige positie, een hydroxylgroep. Indien deze hydroxylgroep niet gedeprotoneerd is, heeft men te maken met de beginstof, benzenol. Benzenol heeft twee resonantiestructuren, en dat zijn de gedelokaliseerde π-elektronen in de ring. Indien benzenol in een basische omgeving wordt gebracht zal benzenol deprotoneren, om zo het fenolaat anion te produceren. Het fenolaat draagt een negatieve lading omdat het elektronpaar dat betrokken was bij de O-H-binding terugslaat op het zuurstof. Dit staat extra resonantiestructuren toe, zoals afgebeeld in figuur 4. Dit gebeurt tevens ook bij carbonzuren zodra deze deprotoneren. Bij deprotonatie slaat het elektronpaar terug op het zuurstof wat extra resonantiestructuren toestaat. Hierdoor zijn gedeprotoneerde carbonzuren overwegend stabiel, en een molecuul als styreen (ethenylbenzeen) is extra stabiel vanwege de gecombineerde effecten van resonantie en conjugatie.Aromaticiteit
Resonantiestructuren zijn erg belangrijk om bepaalde organische eigenschappen te kunnen verklaren. Zo kan resonantie ook een rol spelen bij de aromaticiteit van een molecuul. Om aromatisch te zijn dient een molecuul aan de volgende vier regels te voldoen:[OLIST]Het molecuul is plat
Het molecuul is cyclisch
Het molecuul is geconjugeerd (de enkele en dubbele bindingen wisselen elkaar af)
Het molecuul heeft 4n + 2 π-elektronen (Wet van Hückel)[/OLIST]
Als voorbeeld beschouwt men benzeen. Benzeen is een aromatisch molecuul omdat deze voldoet aan de vier vereisten voor aromaticiteit: het is plat, cyclisch, de dubbele en enkele bindingen wisselen elkaar af, en door zijn 6 π-elektronen voldoet het molecuul aan de vereisten en is zodoende aromatisch. Aromaticiteit van een molecuul zegt veel over de interne potentiële energie en de stabiliteit van een molecuul. Zo zijn aromaten uiterst stabiel, hebben ze een potentiële lagere energie en reageren ze doorgaans moeilijk. De stabiliteit van een aromatisch molecuul is dikwijls te vinden in de hoeveelheid resonantiestructuren die mogelijk zijn voor een dergelijke stof.
Anti-aromaticiteit
Een stof kan dus aromatisch zijn, wat de interne energie van het molecuul ten goede komt. Het is ook goed mogelijk voor een stof om anti-aromatisch te zijn. Bij anti-aromaticiteit komt het volgende kijken:
[OLIST]Het molecuul is plat
Het molecuul is cyclisch
Het molecuul is geconjugeerd (de enkele en dubbele bindingen wisselen elkaar af)
Het molecuul heeft 4n π-elektronen (Wet van Hückel)[/OLIST]
Een voorbeeld van een anti-aromatisch molecuul is cyclobuta-1,3-dieen, die 4 π-elektronen bevat. Cyclobuta-1,3-dieen is zeer reactief en dimeriseert met zichzelf waardoor het molecuul in bulk zeer instabiel is.