Waarom is water zo speciaal?
 Waarom is er geen leven op andere planeten als er geen water is? Water is zeer belangrijk voor het voortbestaan van de aarde. Water wordt in de chemie H2O genoemd, de H staat voor waterstof en de O voor zuurstof. Op aarde komt zo’n 1.400.000.000 km3 aan water voor. Waarvan 97% bestaat uit zeewater. Waar is al dat water dan goed voor? Water heeft zeer veel belangrijke en uitzonderlijke eigenschappen.
Waarom is er geen leven op andere planeten als er geen water is? Water is zeer belangrijk voor het voortbestaan van de aarde. Water wordt in de chemie H2O genoemd, de H staat voor waterstof en de O voor zuurstof. Op aarde komt zo’n 1.400.000.000 km3 aan water voor. Waarvan 97% bestaat uit zeewater. Waar is al dat water dan goed voor? Water heeft zeer veel belangrijke en uitzonderlijke eigenschappen.Inhoud artikel
- De fysische eigenschappen van water
- Kookpunt is afhankelijk van de luchtdruk
- Watermoleculen blijven bij elkaar
- Oplosbaarheid van een scala aan stoffen
- Water geleidt elektriciteit
- Het stabiliseren van de temperatuur
- Water is zowel een zuur als een base
De fysische eigenschappen van water
Water (H2O) kan zich in de natuur in drie fasen bevinden: vloeistof, vast en gas. Bij normale druk bevindt het water zich tussen de 0 graden en 100 graden Celsius in vloeibare toestand. Onder de 0 graden Celsius is water een vaste stof, ook wel ijs. Boven de 100 graden Celsius is water een gas.Kookpunt is afhankelijk van de luchtdruk
De temperatuurgrenzen waarin water naar een andere fysische toestand gaat zijn afhankelijk van de luchtdruk. Het verdampen van water zal bij een lage luchtdruk op een lagere temperatuur gebeuren. Dus op de Mount Everest waar de luchtdruk zeer laag is zal het water al koken bij 68 graden Celsius. Dit maakt het koken van een lekker eitje bovenop de Mount Everest een onmogelijke taak. Het koken van het ei vereist namelijk een temperatuur van 85 graden Celsius. Omgekeerd geldt hetzelfde als de luchtdruk ergens heel hoog is zal water ook pas op een hogere temperatuur koken.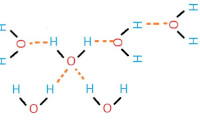 Afb. 1. Waterstofbruggen tussen watermoleculen. Met een oranje stippellijn staat de waterstofbrug weergegeven.
Afb. 1. Waterstofbruggen tussen watermoleculen. Met een oranje stippellijn staat de waterstofbrug weergegeven. Watermoleculen blijven bij elkaar
Heb je ook wel eens de waterjuffers over water heen zien lopen? Als watermoleculen niet bij elkaar zouden blijven plakken zou dit niet mogelijk zijn. Hoe blijven watermoleculen dan bij elkaar plakken? Het bij elkaar blijven van water wordt cohesie genoemd. Ten grondslag van cohesie ligt de waterstofbrug. Een waterstofbrug is een soort van binding tussen het zuurstof atoom (O) van het ene watermolecuul en het waterstofatoom(H) van het andere molecuul. Op afbeelding 1 zijn er waterstofbruggen afgebeeld tussen watermoleculen. De watermoleculen kunnen op deze manier een rooster vormen. Dit rooster is geen vast rooster, maar hervormt zich continu [McMurry & Hoeger]. Door dit rooster kan er zich een soort van vliesje over het water vormen, dit noemen we ook wel de oppervlaktespanning. Hierdoor kunnen kleine insecten zoals de waterjuffer op het water lopen. Water dankt zijn uitzonderlijke eigenschappen aan waterstofbruggen [Campbell & Reece].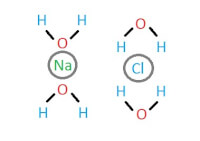 Afb. 2. Oplosproces van keukenzout in water. Het water vormt een schil rond de natrium en de chloride ionen
Afb. 2. Oplosproces van keukenzout in water. Het water vormt een schil rond de natrium en de chloride ionen