Aggregatietoestanden en intermoleculaire krachten
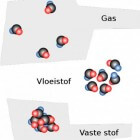 De aggregatietoestand van een stof (vast, vloeibaar of gasvormig) staat in direct verband met de intermoleculaire krachten (cohesiekrachten) die heersen tussen de stofdeeltjes. Deze intermoleculaire aantrekkingskrachten zijn steeds elektrische van aard en zijn afhankelijk van de heersende temperatuur en druk.
De aggregatietoestand van een stof (vast, vloeibaar of gasvormig) staat in direct verband met de intermoleculaire krachten (cohesiekrachten) die heersen tussen de stofdeeltjes. Deze intermoleculaire aantrekkingskrachten zijn steeds elektrische van aard en zijn afhankelijk van de heersende temperatuur en druk.
Inhoud
- Intermoleculaire krachten
- Aggregatietoestanden
- Vaste stof
- Vloeistof
- Gas
- Soorten intermoleculaire krachten
- Waterstofbruggen
- Dipoolkrachten
- Ion-dipoolkrachten
- Van der Waalskrachten
Intermoleculaire krachten
Intermoleculaire krachten zijn krachten die ervoor zorgen dat er aantrekking of afstoting is tussen verschillende moleculen. Zij zorgen ervoor dat een grote groep moleculen samenblijft.Aggregatietoestanden
Vaste stof
De intermoleculaire krachten tussen de deeltjes zijn heel groot. De deeltjes hebben niet voldoende energie om de cohesiekrachten te overwinnen. Ze kunnen alleen maar ter plaatse trillen. Vaste stoffen hebben hierdoor een vaste vorm en dus ook een vast volume.Vloeistof
De intermoleculaire krachten zijn kleiner dan bij een vaste stof en de deeltjes hebben meer bewegingsenergie. De deeltjes hebben nu genoeg energie om door elkaar te bewegen. Ze hebben dus steeds andere buurdeeltjes. Een vloeistof heeft hierdoor geen vaste vorm. De cohesiekrachten zijn wel groot genoeg om de vloeistofmassa bij elkaar te houden. Een vloeistof heeft hierdoor dus wel een vast volume.Gas
De intermoleculaire krachten zijn zeer gering en de deeltjes hebben veel bewegingsenergie. Daardoor kunnen de deeltjes van elkaar weg bewegen en zal een gas een zo groot mogelijk volume willen innemen. Een gas heeft dus geen constant volume en willen we een gas bewaren moeten we het in een gesloten vat brengen.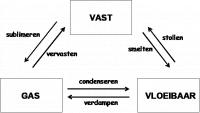 faseovergangen
faseovergangenSoorten intermoleculaire krachten
Er zijn vier soorten intermoleculaire krachten.- Waterstofbruggen
- Dipoolkrachten
- Ion-dipoolkrachten
- Van der Waalskrachten
Je zou ook de ion-ionkracht kunnen vermelden maar deze kracht wordt gerekend bij de chemische bindingen, de ionbinding, en dus niet bij de intermoleculaire krachten.
Waterstofbruggen
Wanneer moleculen H-atomen bevatten welke gebonden zijn aan kleine atomen met een grote elektronegativiteit (EN) (N, O, F), dan kunnen deze moleculen onderling waterstofbruggen vormen. Een grote elektronegativiteit betekent dat die atomen elektronen naar zich toetrekken. Stikstof (N), zuurstof (O) en fluor (F) zijn voorbeelden van atomen met een grote EN.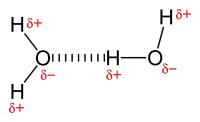 waterstofbruggen tussen watermoleculen / Bron: Publiek domein, Wikimedia Commons (PD)
waterstofbruggen tussen watermoleculen / Bron: Publiek domein, Wikimedia Commons (PD)Ammoniak (NH3) vertoont ook waterstofbruggen maar NH3 is bij kamertemperatuur toch gasvormig in tegenstelling tot water. Dit kan verklaart worden door de lagere EN van stikstof (3.0) in vergelijking met die van zuurstof. Watermoleculen vormen dus onderling sterkere waterstofbruggen dan ammoniakmoleculen.
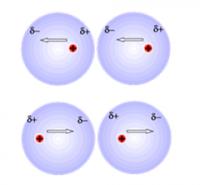
Dipoolkrachten
Als moleculen positieve deelladingen bevatten, dan worden deze aangetrokken door de negatieve deelladingen van andere moleculen. De grootte van de dipoolkrachten is afhankelijk van de sterkte van de deelladingen. Deze sterkte wordt hier ook bepaald door de EN-waarden van de betrokken atomen.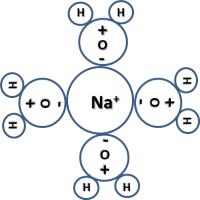 natriumion met watermantel
natriumion met watermantel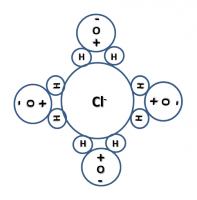 chloorion met watermantel
chloorion met watermantelIon-dipoolkrachten
Als je keukenzout (NaCl) in water brengt, zal dit dissociëren in positieve ionen (Na+) en negatieve ionen (Cl-). Nadat het kristalrooster is afgebroken, zullen deze ionen worden gehydrateerd. Het keukenzout lost dus op in het water.De bindingen tussen de ionen en de dipoolmoleculen van een oplosmiddel zijn sterker naarmate de lading van het positieve ion en het negatieve ion en het dipoolmoment van de moleculen van het solvent groter zijn. Als je zout toevoegt aan water, zal er meer warmte nodig zijn om de watermoleculen in de gasfase te krijgen. Er treedt dus een kookpuntsverhoging op.
 Van der Waalskrachten
Van der WaalskrachtenVan der Waalskrachten
Dit zijn zwakke intermoleculaire krachten welke het gevolg zijn van tijdelijke schommelingen in de ladingswolken van de deeltjes. Door deze schommelingen ontstaan tijdelijke negatieve en positieve ladingscentra. De tijdelijke positieve ladingscentra van een molecule zullen de tijdelijke negatieve ladingscentra van een ander molecule aantrekken. De sterkte is afhankelijk van de polariseerbaarheid van een molecule.Algemeen kan gesteld worden dat een groot molecule een grotere polariseerbaarheid vertoont. Dit komt omdat grotere moleculen een groter aantal elektronen bevatten. Dit komt tot uiting als je eenvoudige alkanen beschouwd. Tussen alkaanmoleculen (CnH2n+2) onderling bestaan er enkel Van der Waalskrachten. De kleinere alkanen vertonen een zwakkere interactie dan de grotere. De kleinere alkanen zoals bijvoorbeeld propaan (C3H8) zijn bij kamertemperatuur dus gasvormig en de grotere alkanen zoals bijvoorbeeld octadecaan (C18H38) zijn in dezelfde omstandigheden vast. Een tussenliggend alkaan zoals bijvoorbeeld decaan (C10H22) is bij kamertemperatuur vloeibaar.
© 2020 - 2024 Guust2016, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 De scheikundige werking van een instant coldpackIn de sportwereld wordt er regelmatig gebruik gemaakt van een instant coldpack om zwellingen bij blessures te voorkomen…
De scheikundige werking van een instant coldpackIn de sportwereld wordt er regelmatig gebruik gemaakt van een instant coldpack om zwellingen bij blessures te voorkomen…
 Scheikunde - verbindingenTussen atomen en moleculen kunnen allerlei krachten van toepassing zijn. Er zijn veel verschillende soorten bindingen. D…
Scheikunde - verbindingenTussen atomen en moleculen kunnen allerlei krachten van toepassing zijn. Er zijn veel verschillende soorten bindingen. D…
 Rekenen met gassenWanneer een stof in de gasfase zit heeft die bijzondere eigenschappen. In dit artikel zullen we kort bespreken hoe je me…
Rekenen met gassenWanneer een stof in de gasfase zit heeft die bijzondere eigenschappen. In dit artikel zullen we kort bespreken hoe je me…
 Molecuultheorie en temperatuurDe molecuultheorie is een belangrijke theorie in de natuur- en scheikunde. De molecuultheorie heeft onze kijk op stoffen…
Molecuultheorie en temperatuurDe molecuultheorie is een belangrijke theorie in de natuur- en scheikunde. De molecuultheorie heeft onze kijk op stoffen…
 De zeven perioden van het periodiek systeemHorizontaal wordt het periodiek systeem ingedeeld in 7 perioden. Deze indeling werd gedaan op basis van de 7 schillen ui…
De zeven perioden van het periodiek systeemHorizontaal wordt het periodiek systeem ingedeeld in 7 perioden. Deze indeling werd gedaan op basis van de 7 schillen ui…
 Metalen zuiveren met behulp van elektriciteitMet behulp van elektrolyse kan je een ruw (verontreinigd) metaal zuiveren. Je laat het metaal hierbij anodisch oxideren…
Metalen zuiveren met behulp van elektriciteitMet behulp van elektrolyse kan je een ruw (verontreinigd) metaal zuiveren. Je laat het metaal hierbij anodisch oxideren…
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: Luis Javier Rodriguez Lopez, Wikimedia Commons (CC BY-SA/bewerkt)
- Afbeelding bron 1: Publiek domein, Wikimedia Commons (PD)
- Afbeelding bron 2: Benjah-bmm27, Wikimedia Commons (Publiek domein)
Guust2016 (74 artikelen)
Gepubliceerd: 13-03-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Gepubliceerd: 13-03-2020
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 3
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.