Kobalt: Het element
 Kobalt is een glimmend ferromagnetisch, zilver-wit, hard doch bros metaal (element). Het lijkt op nikkel maar met een blauwachtige tint. Het kan gemagnetiseerd worden. Het metaal is stabiel in lucht en water maar wordt aangetast door verdund zuur. Het is bekend als kobaltblauw en als radioactief kobalt die door bestralen voedsel houdbaar maakt en in ziekenhuizen wordt gebruikt voor bestralen van tumoren. De grootste afnemers zijn echter staalfabrieken omdat kobalt hoofdlegeringselement is in hoogwaardige metaallegeringen.
Kobalt is een glimmend ferromagnetisch, zilver-wit, hard doch bros metaal (element). Het lijkt op nikkel maar met een blauwachtige tint. Het kan gemagnetiseerd worden. Het metaal is stabiel in lucht en water maar wordt aangetast door verdund zuur. Het is bekend als kobaltblauw en als radioactief kobalt die door bestralen voedsel houdbaar maakt en in ziekenhuizen wordt gebruikt voor bestralen van tumoren. De grootste afnemers zijn echter staalfabrieken omdat kobalt hoofdlegeringselement is in hoogwaardige metaallegeringen. Kobalt / Bron: Alchemist hp, Wikimedia Commons (FAL)
Kobalt / Bron: Alchemist hp, Wikimedia Commons (FAL)Kobalt ertsen
In de aardkorst komt kobalt o.a. voor als erythriet, skutterudiet, cobaltiet. De grootste hoeveelheden kobalterts worden gedolven in Azie, Afrika en Australië. Kobalt wordt meestal verkregen als bijproduct bij de winning van nikkel, zilver, ijzer koper en lood. Het is een component van vitamine B12; ons lichaam bevat circa 1,5 gram kobalt. Snelstaal / Bron: Clemens Pfeiffer, Wikimedia Commons (CC BY-2.5)
Snelstaal / Bron: Clemens Pfeiffer, Wikimedia Commons (CC BY-2.5)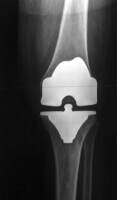 Prothese: Kniegewricht uit Vitallium een legering van kobalt, chroom en molybdeen / Bron: fpjacquot, Wikimedia Commons (CC BY-SA-3.0)
Prothese: Kniegewricht uit Vitallium een legering van kobalt, chroom en molybdeen / Bron: fpjacquot, Wikimedia Commons (CC BY-SA-3.0)Legeringselement kobalt
Kobalt werd als legeringselement voor het eerst gebruikt in sneldraaistaal soorten en stond aan de basis van de ontwikkeling van een een reeks van superieure legeringen, zoals hitte-en corrosievast staal, staal met specifieke magnetische eigenschappen en staal met superieure mechanische eigenschappen. Het zijn complexe legeringen die niet eenvoudig zijn in te delen op basis van hun chemische samenstelling, maar moeten ze globaal indelen op basis van hun toepassingsgebied.| Kobalt symbool | Co |
|---|---|
| Atoomnummer | 27 |
| Atoommassa | 58,94 |
| Kleur | ziverkleurig |
| Dichtheid(20°C) | 8,9 g/cm3 |
| Smeltpunt | 1493°C |
| Kookpunt | 3100°C |
| Kristalstructuur: T<417°C T > 417°C | α hexagonaal rooster β Kubisch vlakken rooster |
| Aggregatietoestand | vast |
| Specifieke warmte (0-100°C) | 0,105 cal/g/°C |
| Warmtegeleidingsvermogen (0-100°C) | 0,165 cal/cm2/cm/s/°C |
| Electrische weerstand (20°C) | 6,30 microhm cm |
| Liniaire uitzettingscoefficient (20°C) | 3,8.10-6/°C |
| Magnetische permeabiliteit | initieel 68; max. 245 |
| Curiepunt | 1121°C |
| Mechanische eigenschap kobalt | Gegoten en gegloeid |
| Treksterkte N/mm2 | 240 |
| Strekgrens N/mm2 | 220 |
| Breukrek % | 0-4 |
| Hardheid HB | 127 |
| Elasticiteitsmodules E N/mm2 | 210.000 |
Indeling hooggelegeerde stalen op basis van hun toepassingsgebied
- Superlegeringen (superalloys): De speciale corrosievaste hittebestendige legeringen.
- Legeringen met speciale magnetische eigenschappen: De Kobalt - ijzer legeringen als AlNiCo, CuNiCo, Hyperco en Permindur.
- Legeringen voor gereedschap en weerstand tegen (abrasie) slijtage: De legeringen als Sneldraaistaal en Stelliet.
- Legeringen ontwikkeld voor hele specifieke toepassingen: Invar een legering die niet uitzet bij temperatuurverhoging, Co-elinvar een legering met constante elasticiteitsmodules, Vitallium voor implantaten, Elgiloy een verenstaal met hoge vermoeiingsterkte.
 Kobalt blauw / Bron: Caleb Moore, Wikimedia Commons (Publiek domein)
Kobalt blauw / Bron: Caleb Moore, Wikimedia Commons (Publiek domein)Toepassingen
- kobalt(II)oxide, (kobaltblauw) wordt gebruikt als pigment voor verf en het kleuren van glas, porselein, aardewerk en tegels.
- Kobalt is ferromagnetisch en gebruikt als component in sterke permanente magneten.
- Katalysator in de chemische- en olieindustrie.
- Elektroden in batterijen.
- Radioactieve isotoop Kobalt 60 is een bron van gammastraling en wordt toegepast bij houdbaar maken van voedsel door bestraling. Het wordt gebruikt om verschillende vormen van kanker te behandelen.
- Electroplating om voorwerpen een aantrekkelijk oxidatiebestendig oppervlak te geven.
- Hoofdlegeringselement in hoogwaardige metaallegeringen voor o.a. vliegtuigmotoren en gasturbines, magnetisch staal en sommige typen roestvast staal.
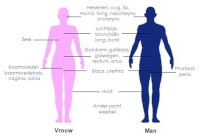 Delen van het lichaam waar de stralingsbron kobalt 60 geplaatst kan worden om een tumor te behandelen / Bron: Rock mc1, Wikimedia Commons (Publiek domein)
Delen van het lichaam waar de stralingsbron kobalt 60 geplaatst kan worden om een tumor te behandelen / Bron: Rock mc1, Wikimedia Commons (Publiek domein) - Kobalt wordt gebruikt in veel legeringen (corrosiebestendige legeringen, high-speed staal (HSS snelstaal), hardmetaal), in magneten, voor katalysatoren voor de aardolie-en chemische industrie.
- Stelliet legeringen, staal gelegeerd met kobalt, chroom en wolfraam, worden gebruikt voor de vervaardiging van gereedschap voor zware belasting en hogere temperaturen.
- Alniko, een legering die bestaat uit aluminium, nikkel en kobalt, wordt gebruikt om zeer krachtige magneten te maken.
Milieu en gezondheid
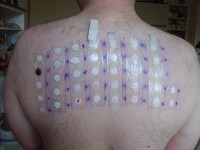 Plakproeven om de soort metaalallergie vast te stellen / Bron: Jan Pol, Wikimedia Commons (CC BY-SA-3.0)
Plakproeven om de soort metaalallergie vast te stellen / Bron: Jan Pol, Wikimedia Commons (CC BY-SA-3.0)Kobalt is een onderdeel van vitamine B12, dat onmisbaar is voor onze gezondheid. Kobalt wordt gebruikt om bloedarmoede bij zwangere vrouwen te behandelen, het stimuleert aanmaak van rode bloedcellen. Te hoge concentraties kobalt schaden de gezondheid. Kobalt inademen via de lucht kan astma en longontsteking veroorzaken. Dit komt voor bij mensen die met kobalt werken. of planten gegeten worden die op besmette grond groeien, kobalt hoopt zich op in de zaden en fruit.
Symptomen t.g.v. van hoge concentraties kobalt
- Visuele problemen
- Overgeven en misselijkheid
- Schade aan de schildklier
- Hartproblemen
Blootstelling radioactieve kobalt 60 straling
Kobalt kan in de grond en water terecht komen door regenwater dat door de bodem en rotsen stroomt die kobalt bevatten. Grond bij mijn- en smeltfabrieken kunnen te hoge concentraties kobalt bevatten. Zo komt het in water, bodem, plant en dier en tenslotte ook in ons lichaam. Kobalt aërosolen kunnen ademhalingsproblemen, ziekte van de luchtwegen, longen en blijvende handicaps veroorzaken.Gezondheidsklachten kunnen ook veroorzaakt worden door bestralen met radioactieve kobaltisotopen. Dit kan leiden tot onvruchtbaarheid, haaruitval, overgeven, bloeden, diarree, coma en de dood. Deze straling wordt gebruikt bij het bestralen van kankergezwellen.