Curium: Het element
 Curium is een hard, bros, radioactieve zilverachtig metaal. Het komt niet in de natuur voor en moet in een kernreactor gemaakt worden door neutronenvangst afkomstig van plutonium en americium isotopen. Het wordt langzaam aangetast in droge lucht bij kamertemperatuur. De meeste verbindingen Cm(III) zijn geelachtig. Curium in het lichaam accumuleert in botten (merg) en is daar zeer toxisch want zijn straling vernietigt de rode bloedcel aanmaak. De toepassing van curium ligt in het hightech gebeuren zoals de ruimtevaart.
Curium is een hard, bros, radioactieve zilverachtig metaal. Het komt niet in de natuur voor en moet in een kernreactor gemaakt worden door neutronenvangst afkomstig van plutonium en americium isotopen. Het wordt langzaam aangetast in droge lucht bij kamertemperatuur. De meeste verbindingen Cm(III) zijn geelachtig. Curium in het lichaam accumuleert in botten (merg) en is daar zeer toxisch want zijn straling vernietigt de rode bloedcel aanmaak. De toepassing van curium ligt in het hightech gebeuren zoals de ruimtevaart.
Plaats van het element curium in het periodiek systeem
 Periodiek systeem van elementen. Het element curium is een transurane radioactief zeldzaam aardmetaal met symbool Cm en atoomnummer 96. Dit element uit de actiniden serie is vernoemd naar Marie- en Pierre Curie / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
Periodiek systeem van elementen. Het element curium is een transurane radioactief zeldzaam aardmetaal met symbool Cm en atoomnummer 96. Dit element uit de actiniden serie is vernoemd naar Marie- en Pierre Curie / Bron: Kushboy, Wikimedia Commons (CC BY-SA-3.0) Glenn T Seaborg / Bron: Atomic Energy Commission, Wikimedia Commons (Publiek domein)
Glenn T Seaborg / Bron: Atomic Energy Commission, Wikimedia Commons (Publiek domein) Curium werd voor het eerst geproduceerd door Glenn T Seaborg en medewerkers in 1944 aan de Berkeley universiteit door in de cyclotron plutonium-239 te bombarderen met α-deeltjes. Het is geïsoleerd in 1947 in een macroscopische hoeveelheid curiumhydroxide Cm(OH)3.
Curium werd voor het eerst geproduceerd door Glenn T Seaborg en medewerkers in 1944 aan de Berkeley universiteit door in de cyclotron plutonium-239 te bombarderen met α-deeltjes. Het is geïsoleerd in 1947 in een macroscopische hoeveelheid curiumhydroxide Cm(OH)3./ Bron: Department of Energy. Office of Public Affairs, Wikimedia Commons (Publiek domein)
Algemene eigenschappen van het element Curium
| Naam | Symbool | Atoomnummer | Groep | Periode | Blok | Reeks | Kleur |
|---|---|---|---|---|---|---|---|
| Curium | Cm | 96 | n/a | Periode 7 | F-blok | Actiniden | Zilverachtig metalliek |
Chemische eigenschappen van het element Curium
| Atoom- massa (u) | Elektronen- configuratie | Elektro- negativiteit (Pauling) | Atoom- straal (pm) | Ionisatie- potentiaal (KJ/mol) | oxidatie toestand | Aggregatie- toestand (20 C) |
|---|---|---|---|---|---|---|
| 247 | [Rn] 5f7 6d1 7s2 per shell 2, 8, 18, 32, 25, 9, 2 | 1.3 | Covalent rad. 169±3 empirische rad: 174 | 1st: 581 kJ/mol | 8,[1] 6,[2] 4, 3, 2 (anamphoteric oxide) | Vast |
Fysische eigenschappen van het element curium
| Dicht- heid (0 °C) (g/cm3) | Smelt- punt (K) | Kook- punt (K) | Smelt- warmte (KJ/mol) | Verdamp- ings- warmte (KJ/mol) | Kristal- structuur | Warmte- geleiding (W/ m.K | Elek- trische weer- stand (nΩ.m) | Magnet- isme |
|---|---|---|---|---|---|---|---|---|
| 13.51 bij 0 °C | 1613 K 1340 °C 2444 °F | 3383 K 3110 °C 5630 °F | 15 | --- | hexagonal closepacked (hcp) | ---- | 1.25 | Antiferro magnetisch, omslag naar paramagnetisch bij 52 K |
Isotopen van Curium
| Isotoop: | 242Cm | 243Cm | 244Cm | 245Cm | 246Cm | 247Cm | 248Cm | 250Cm |
|---|---|---|---|---|---|---|---|---|
| Kritische massa (kg): | 25 | 7,5 | 33 | 6,8 | 39 | 7 | 40,4 | 23,5 |
Isotopen van Curium zijn radioactief met een kleine kritische massa voor een kettingreactie. Ongeveer 20 radio-isotopen van curium tussen 233Cm en 252Cm zijn bekend. Er zijn geen stabiele isotopen. De langste halfwaardetijden voor 247Cm (15,6 miljoen jaar) en 248Cm (348.000 jaar). Andere langlevende isotopen zijn 245Cm (halveringstijd 8500 jaar), 250cm (8.300 jaar) en 246Cm (4760 jaar). De meest gebruikte isotopen curium zijn 242Cm en 244cm met halfwaardetijden van 162,8 dagen en 18,1 jaar.
De toepassing van curium wordt belemmerd door zijn schaarste en hoge prijs. 245cm en 247Cm hebben een zeer kleine kritische massa en dus kunnen worden gebruikt in draagbare kernwapens, Curium-243 is niet geschikt voor dit doel vanwege de korte halfwaardetijd en sterke α emissie die zou resulteren in verhitting. Curium-247 zou zeer geschikt zijn.
De stabielste isotopen van Curium
| Isotoop | NA(%) | Halveringstijd | Verval via | vervalenergie (MeV) | Vervalproducten |
|---|---|---|---|---|---|
| 245Cm | Synthetisch | 8500 jaar | alfa | 5,623 | 241Pu |
| 246Cm | Synthetisch | 4730 jaar | alfa | 5,475 | 242Pu |
| 247Cm | Synthetisch | 1,56x10↑7 | alfa | 5,353 | 243Pu |
| 248Cm | Synthetisch | 3,40x10↑5 jaar | alfa | 5,162 | 244Pu |
| 250Cm | Synthetisch | 9700 jaar | alfa | 5,169 | 246Pu |
Het voorkomen van curium
Het radioactieve curium gloeit in het donker. De eerste geproduceerde Curium proefmonsters waren met het blote oog nauwelijks zichtbaar en werden geïdentificeerd door hun radioactief gedrag. Het eerste monster van 30 ug Curium-242 hydroxide werd geproduceerd in 1947 door het bombarderen van americium-241 met neutronen.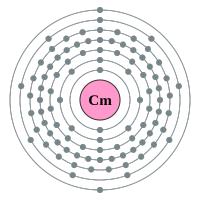 De elektronenmantel van Curium. / Bron: Pumbaa / Greg Robson, Wikimedia Commons (CC BY-SA-2.0)
De elektronenmantel van Curium. / Bron: Pumbaa / Greg Robson, Wikimedia Commons (CC BY-SA-2.0)Kenmerkende eigenschappen van Curium
- Meeste curium wordt geproduceerd door het bombarderen van uranium of plutonium met neutronen in kernreactoren. Eén ton splijtstof bevat ongeveer 20 gram Curium.
- Curium is een harde, zware, zilverachtig metaal met een relatief zeer hoog kookpunt. Het is paramagnetisch bij standaard omstandigheden, maar wordt anti ferromagnetisch bij afkoelen.
- In verbindingen vertoont Curium meestal valentie 3 en soms 4, de valentie 3 toestand overheerst in oplossingen. Curium oxideert gemakkelijk en de oxiden zijn de overheersende vorm van dit element. Het vormt sterke fluorescente complexen met verschillende organische verbindingen.
Toepassingen van Curium
- Curium is radioactief en alleen beschikbaar in kleine hoeveelheden. De toepassingen zijn specialistisch. Curium wordt gebruikt als alfa bron. 244Cm was de alfadeeltjes bron voor de Alpha Proton X-Ray Spectrometer (APXS) op de Mars Rover.
- De warmte die in de radioactieve curium massa vrijkomt kan elektriciteit produceren in radio-isotoop thermo-elektrische generatoren. Deze toepassing wordt belemmerd door de schaarste, hoge kosten en radioactiviteit van curium isotopen.
- De radio-isotoop Heater Unit (Rhus), is een apparaat met een zeer kleine hoeveelheid plutonium die warmte afgeeft om zelfstandig werende ruimteapparaten op werktemperatuur te houden.
- Alfa proton Xray spectrometer (APXS)Er bevindt zich een kleine hoeveelheid radioactief curium in de Alpha-Proton X-Ray Spectrometer (APXS). Dit instrument maakt gebruik van de geëmitteerd alfadeeltjes. Bij plaatsing van de rover tegen een gesteente, zullen deze alfadeeltjes de moleculen in het gesteente treffen, de aangeslagen moleculen zenden straling van allerlei aard uit zoals röntgen, protonen en alfadeeltjes. Het instrument (APXS) analyseert deze door het gesteente geretourneerde straling en bepaalt hieruit de samenstelling van het gesteente.
- Curium wordt gebruikt bij de productie van de 238Pu radio-nucliden, die bestemd zijn voor stroombron in pacemakers.
- Curium diende als α-bron in de alfadeeltjes X-ray spectrometer op de Sojourner, Mars, Mars 96 rd, Athena, Spirit en Opportunity rover en de Mars Science Laboratory om de samenstelling en structuur van de gesteenten te analyseren op Mars en de Maan.
Radionucliden
- De straling van curium zo sterk dat het metaal paars gloeit in het donker.
- Curium is een van de meest radioactieve elementen. De twee meest voorkomende isotopen 242Cm en 244Cm zijn sterke alfastralers (energie 6 MeV); met de relatief korte halfwaardetijden van 162,8 dagen en 18,1 jaar produceren ze respectievelijk 120 W/g en 3 W/g thermische energie. Daarom kan Curium worden gebruikt in radio-isotoop thermo-elektrische generatoren voor ruimtevaartuigen.
- Curium-243 produceert grote hoeveelheden schadelijke gamma en beta straling via zijn radioactieve vervalproducten.
- Curium is uitgangsmateriaal voor de productie van hogere transuranen en transactinides. Bombardement van 248Cm met zuurstof (18 O) of magnesium (26 Mg) levert bepaalde isotopen van seaborgium (265Sg) en Hassium (269Hs en 270Hs).
- Californium werd ontdekt toen Curium-242 werd bestraald met 35 MeV alpha deeltjes met behulp van de 150 cm cyclotron in Berkeley. Er werden circa 5000 atomen californium in dit experiment geproduceerd.
 Alpha Particle X-Ray Spectrometer (APXS) / Bron: NASA JPL Max-Planck-Institute for Chemistry, Wikimedia Commons (Publiek domein)
Alpha Particle X-Ray Spectrometer (APXS) / Bron: NASA JPL Max-Planck-Institute for Chemistry, Wikimedia Commons (Publiek domein)Alpha-particle X-ray spectrometer van de "Mars exploration rover"
Alpha Particle X-Ray Spectrometer (APXS) is een apparaat dat de chemische samenstelling van een monster registreert als het monster wordt bestraald met alfadeeltjes en X-stralen van de radioactieve bron van de (APXS). Een variant is de Alpha Proton X-Ray Spectrometer toegepast in de Pathfinder.De meest praktische toepassing van 244Cm -is als α-deeltje bron in de alpha deeltje X-ray spectrometers (APXS). Deze instrumenten zijn geïnstalleerd op de Sojourner, Mars, Mars 96, Mars Exploration Rovers en Philae komeet lander, alsmede de Mars Science Laboratory om de samenstelling en structuur van de gesteenten te analyseren op het oppervlak van de planeet Mars. (APXS) werd ook gebruikt in de Surveyor 5-7 maan sondes.
Een (APXS} is uitgerust met een sensor en Curium bronnen, die gericht worden op het te onderzoeken gesteente. De energie-spectra van de alfa-deeltjes, protonen etc. die van het gesteente los komen worden geanalyseerd. Deze spectra bevat informatie over de belangrijke elementen in het gesteente.
Kenmerken van curium
- Curium metaal bestaat in twee kristalstructuren: een dubbel-hexagonaal dicht gepakte- en bij hogere temperatuur een vlakken gecentreerd kubisch atoomrooster.
- Curium ionen in oplossing verkeren nagenoeg uitsluitend in oxidatietoestand +3, dat is de stabielste oxidatietoestand voor curium. Een enkele keer komt Cm+4 voor.
- Het chemisch gedrag van curium verschilt van de actiniden thorium en uranium en is vergelijkbaar met die van americium. In waterige oplossing is de Cm3 + ion kleurloos tot licht groen, en CM4 + ion is lichtgeel.
- Verdere neutronenvangst gevolgd door β - verval produceert de 241Am isotoop van americium die verder wordt omgezet tot 242Cm.
- Voor onderzoeksdoeleinden, wordt Curium verkregen door het bestralen van plutonium, die in grote hoeveelheden uit gebruikte splijtstof beschikbaar is.
- Curium-244 vervalt in 240Pu door emissie van alfadeeltjes, maar absorbeert ook neutronen wat resulteert in een kleine hoeveelheid zwaardere isotopen van curium, waaronder 247Cm en 248Cm die populair zijn in wetenschappelijk onderzoek vanwege hun lange halfwaardetijd.
- Curium-248 heeft de voorkeur voor onderzoeksdoeleinden vanwege zijn lange halfwaardetijd. De meest efficiënte bereidingswijze van dit isotoop via α-verval van de californium isotoop 252Cf, die in betrekkelijk grote hoeveelheden voor komt door de lange halfwaardetijd (2,65 jaar). Ongeveer 35-50 mg 248Cm wordt jaarlijks geproduceerd volgens deze werkwijze.
- Ook interessant voor onderzoek is isotoop 245Cm. Deze kan worden verkregen uit de α-verval van californium 249 Cf, die wordt geproduceerd in kleine hoeveelheden via β - verval van de isotoop berkelium 249Bk:
Verbindingen en reacties van curium
Oxides
Curium reageert met zuurstof en vormt Cm2O3 en CmO2 oxides, de tweewaardige oxide CmO is ook bekend. Zwart CmO2 kan worden verkregen door verbranding van curium oxalaat (Cm2(C2O4)3), nitraat (Cm(NO3)3) of hydroxide in zuivere zuurstof. Bij verhitting tot 600-650 ° C in vacuüm, transformeert in witachtig Cm2O3.Verder is een aantal ternaire oxiden van het type M(II)CmO3 bekend, waarbij M staat voor tweewaardige metalen, zoals barium.
Thermische oxidatie van hoeveelheden sporen van Curium hydride (CmH2-3) is gemeld: een vluchtige vorm van CmO2 en produceren de vluchtige trioxide CmO3.
Definities van de verzamelnamen halogeniden en pnictiden
Halogeniden (haliden) verzamelnaam voor zouten die een verbinding vormen tussen een metaal en een halogeen.waterstof op de plaats van een metaal wordt ook tot de halogeniden gerekend. De halogenen en hun halogeniden zijn:
- Fluor (F−) - Fluoriden
- Chloor (Cl−) - Chloriden
- Broom (Br−) - Bromiden
- Jodium (I−) - Jodiden
- Astaat (At−) - Astatiden
- Waterstof (H−) - Hydriden
Pnictiden verzamelnaam voor chemische verbindingen tussen een pnicogeen (element uit de stikstofgroep - de pnicogenen) en een ander element. Nitriden en fosfiden zijn bijvoorbeeld pnictiden, stikstofoxiden worden tot de pnictiden gerekend.
Halogeniden
De kleurloze curium(III)fluoride (CmF3) kan worden geproduceerd door het inbrengen fluoride-ionen in curium (III) bevattende oplossing. De bruine vierwaardige curium (IV) fluoride (CmF4) daarentegen wordt alleen verkregen door curium (III) fluoride met moleculaire fluor:De kleurloze curium(III) chloride (CmCl3) wordt geproduceerd in de reactie van curium(III) hydroxide (Cm(OH3)) met anhydroushydrogen chloride gas. Het kan verder worden omgezet in andere halogeniden, zoals curium(III)bromide (kleurloos tot lichtgroen) en curium(III) jodide (kleurloos), door reactie met het ammoniumzout van het overeenkomstige halogenide bij verhoogde temperatuur van ongeveer 400-450 ° C:
Invloed van Curium op milieu en volksgezondheid
- Curium heeft geen biologische functie in het lichaam en hoort niet in het lichaam thuis.
- Door zijn hoge radioactiviteit moet Curium en zijn verbindingen in speciale laboratoria worden bestudeert.
- Overwegende Curium zelf straalt vooral α-deeltjes die worden geabsorbeerd door dunne lagen van gewone materialen, een aantal van haar verval producten uitstoten fracties van bèta- en gamma-straling, die een meer uitgebreide bescherming nodig.
- Curium wordt uitgescheiden binnen een paar dagen en slechts 0,05% wordt opgenomen in het bloed. Vanaf daar gaat 45% naar de lever, 45% naar de botten en de resterende 10% wordt uitgescheiden.
- In het bot, curium ophoopt in bot en beenmerg; de straling beschermt het beenmerg en stopt de aanmaak van rode bloedcellen. De biologische halfwaardetijd van curium is ongeveer 20 jaar in de lever en 50 jaar in de botten. Curium wordt veel sterker geabsorbeerd in het lichaam via inhalatie dan via inname.
- Curium isotopen zijn aanwezig in verbruikte splijtstof met een concentratie van ongeveer 20 g/ton. Onder hen de 245Cm-248Cm isotopen vervaltijden duizenden jaren moeten worden verwijderd. De bijbehorende werkwijze omvat verschillende stappen, waarbij curium eerst wordt gescheiden en vervolgens omgezet door neutronenbeschieting in speciale reactoren kort- neutraliseren leefde nucliden. Deze kerntransmutatie procedure is nog in ontwikkeling.
- Curium komt niet van nature voor in de biosfeer en is dus geen risico. Het element wordt bestudeerd in speciale laboratoria voor hoog radioactieve stoffen.
- Ingebracht in het menselijk lichaam, accumuleert curium in botten, longen en lever, waar het kanker bevordert.
- In beenmerg waar het gevaarlijk is vanwege de radioactiviteit die de aanmaak van rode bloedcellen verstoort.
© 2014 - 2025 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Livermore: Het elementLivermorium is de synthetische superzware, niet in de natuur voorkomende, element met het symbool Lv en atoomnummer 116.…
Livermore: Het elementLivermorium is de synthetische superzware, niet in de natuur voorkomende, element met het symbool Lv en atoomnummer 116.…
 Lawrencium: Het elementLawrencium is een synthetisch chemisch element met een chemisch symbool Lr en atoomnummer 103. Het is een radioactief me…
Lawrencium: Het elementLawrencium is een synthetisch chemisch element met een chemisch symbool Lr en atoomnummer 103. Het is een radioactief me…
 Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
Meitnerium: Het elementMeitnerium is een scheikundig element met symbool Mt en atoomnummer 109. Het is een zeer radioactief synthetische elemen…
 Copernicium: Het elementCopernicium is synthetisch gemaakt in 1996, door Peter Armbruster and Gottfried Münzenber (Gesellschaft fur Schwerionenf…
Copernicium: Het elementCopernicium is synthetisch gemaakt in 1996, door Peter Armbruster and Gottfried Münzenber (Gesellschaft fur Schwerionenf…
 Berkelium, het elementBerkelium is een kunstmatig zacht, zilverwit, radioactief metaal. Het is ontdekt in Lawrence Berkeley National Laborator…
Berkelium, het elementBerkelium is een kunstmatig zacht, zilverwit, radioactief metaal. Het is ontdekt in Lawrence Berkeley National Laborator…
 Plutonium: Het elementPlutonium is een zwaar metaal met een metallic zilvergrijs uiterlijk. Blootgesteld aan lucht, ontstaat door oxidatie een…
Plutonium: Het elementPlutonium is een zwaar metaal met een metallic zilvergrijs uiterlijk. Blootgesteld aan lucht, ontstaat door oxidatie een…
Gerelateerde artikelen
Bronnen en referenties
- http://www.webelements.com/curium/
- http://en.wikipedia.org/wiki/Curium
- http://nl.wikipedia.org/wiki/Halogenide
- http://news.nost.jp/2010/12/zeldzame-en-schaarse-metalen/
- http://nl.wikipedia.org/wiki/Pnictiden
- http://sciencenotes.org/?attachment_id=320
- http://www.jpl.nasa.gov/multimedia/mer-yr5/index.swf
- http://200612313nps.edu.glogster.com/curium-4579
- Afbeelding bron 1: Kushboy, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 2: Atomic Energy Commission, Wikimedia Commons (Publiek domein)
- Afbeelding bron 3: Department of Energy. Office of Public Affairs, Wikimedia Commons (Publiek domein)
- Afbeelding bron 4: Pumbaa / Greg Robson, Wikimedia Commons (CC BY-SA-2.0)
- Afbeelding bron 5: NASA JPL Max-Planck-Institute for Chemistry, Wikimedia Commons (Publiek domein)
Custor (173 artikelen)
Laatste update: 15-02-2017
Rubriek: Wetenschap
Subrubriek: Natuurkunde
Bronnen en referenties: 13
Laatste update: 15-02-2017
Rubriek: Wetenschap
Subrubriek: Natuurkunde
Bronnen en referenties: 13
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.