Fotonen voor dummies
Licht is een heel speciaal verschijnsel. We staan er in het dagelijks leven niet vaak bij stil, maar ook licht bestaat uit deeltjes. Deze deeltjes hebben alleen iets speciaals: ze kunnen zich zowel als deeltje maar ook als golf gedragen. Bovendien hebben deze deeltjes geen massa. Waar komen deze deeltjes vandaan en hoe werken deze deeltjes? Eerst is het van belang om te weten hoe een atoom is opgebouwd. Daarna komt het verband tussen elektronen en fotonen aan bod. Daarna wordt verteld hoe atomen in een geladen toestand kunnen komen. Ten slotte wordt er verteld over EM-straling. Licht is een vorm van EM-straling.Algemene informatie atoom
Een atoom is opgebouwd uit een kern en schillen om de kern heen. De kern bestaat uit protonen (positief van lading) en neutronen (geen lading). In de schillen om de kern heen zitten elektronen (negatief van lading). In een neutraal atoom zitten evenveel protonen en elektronen.Neutraal atoom = aantal protonen – aantal elektronen = 0

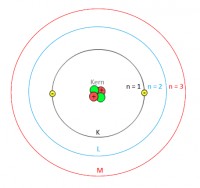
Het atoommodel van Bohr
Niels Bohr stelde dat elektronen van een atoom in (soms meerdere) schillen rond de kern zitten. Deze schillen heeft hij benoemd, vanaf de kern naar buiten: K-L-M-N-O-P-Q. Het rangnummer is schilnummer n. Dus schil K is schilnummer n = 1. De hoeveelheid elektronen die een schil maximaal kan hebben wordt bepaald met een formule: Maximaal elektronen in schil n = 2n2.Deze regel is echter alleen geldig van n=1 t/m n=4. Vanaf n=5 kan een schil maximaal 32 elektronen bevatten. Let op! De buitenste schil heeft altijd maximaal 8 elektronen.
Aangeslagen toestand
De schillen zijn energiebanen. Alle schillen behalve de binnenste schil zijn energieniveaus. Elektronen kunnen van een lagere schil naar een hogere schil gaan. Als een elektron in een hogere schil is, is deze elektron in aangeslagen toestand. Hierbij nemen ze een bepaalde hoeveelheid energie op. Er zijn 3 manieren waarop een atoom in aangeslagen toestand kan komen:- Door verhitting
- Door botsingen met andere elementen
- Door absorptie van een foton (hier wordt later op ingegaan)
Fotonen
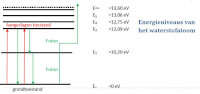
Een elektron kan ook van een hogere schil naar een lagere schil gaan. Hierbij krijgen de elektronen overtollige energie. Deze energie doen ze in energiepakketjes, ook wel fotonen genoemd. Fotonen worden uitgezonden door aangeslagen elektronen en bestaan uit de vrijgekomen energie. Een elektron kan ook in stapjes terugvallen, dus dat hij niet gelijk terugspringt naar de eerste schil. Hierbij zendt de elektron meerdere fotonen uit met een lagere hoeveelheid energie dan dat het elektron opgenomen heeft.De grondtoestand
Als alle elektronen in schil K zitten is het atoom stabiel. Als een elektron het laagste energieniveau heeft is het elektron in de grondtoestand. In de grondtoestand heeft het elektron geen energie.De elektronvolt
De energie van een foton is erg klein. Daarom is er een nieuwe eenheid bedacht, de elektronvolt (eV).1 eV = 1,60 · 10-19 J 1 eV =4,44 · 10-26 kWh Het verband J en kWh: n J = n /3,6 · 106kWh 1 Watt = 1 Joule per seconde,3600 seconden in een uur, meter naar kilometer = /1000
Algemene informatie ion
Een ion is een atoom of meerdere atomen die elektrisch geladen zijn, door een gebrek aan of een overschot aan elektronen. Als het deeltje een elektron kwijt raakt dan wordt het deeltje positief geladen (er zijn meer protonen dan elektronen), als het deeltje er een elektron bij krijgt is het elektron negatief geladen (er zijn meer elektronen dan protonen). Het proces waarbij een ion wordt gevormd heet ionisatie.Een positief geladen ion
Een atoom kan zoveel energie opnemen (door botsing, verhitting of door het opnemen van een foton) dat het elektron zoveel energie krijgt dat hij losraakt van de schillen. De energie die minimaal nodig is om een elektron los te maken van de schillen is de ionisatie-energie. Bij het ioniseren is het niet nodig dat er precies de ionisatie-energie wordt opgenomen. Er kan ook meer energie worden opgenomen, deze energie krijgt het elektron dan mee in kinetische energie (bewegingsenergie, snelheid). Er moet dus minimaal de ionisatie-energie geabsorbeerd worden. De energie waarmee het elektron vrijgemaakt wordt heet de uittree-arbeid. De uittree-arbeid van een foton is gelijk aan de energie van een foton. Dit is dus niet perse de ionisatie-energie.Let op! 1 elektron absorbeert 1 foton. Fotonen kunnen niet samenwerken om 1 elektron vrij te maken.

Een negatief geladen ion
Een positief geladen ion zal een grote aantrekkingskracht uitoefenen op elektronen. Hij heeft er immers 1 (of meerdere) te weinig. Zodra hij een elektron binnenkrijgt neemt de energie van het elektron af, deze vrijgekomen/overtollige energie wordt uitgezonden door middel van een foton. Er moet dus minimaal de ionisatie-energie geabsorbeerd worden.
Een neutraal atoom
En neutraal atoom kan ook in aanraking komen met een elektron. Maar een neutraal atoom kan geen lading hebben (hij is neutraal). Het elektron zal botsen met de neutron en krijgt meer energie.Samenvatting
Dus: een elektron kan:- Een elektron uit een atoom wegslaan.
- Botsen met een neutraal atoom zonder dat het opgenomen wordt.
- Worden opgenomen door een positief atoom.
Algemene informatie EM-straling
Licht is één van de vormen van elektromagnetische straling, die door de cellen in onze ogen waargenomen wordt. Andere vormen van elektromagnetische straling zijn bijvoorbeeld ultraviolet, infrarood en röntgenstraling. Straling is een vorm van energie. Elektromagnetische straling (oftewel EM-straling) is het voortbewegen van elektrische en magnetische trillingen. EM-straling heeft geen medium nodig waardoor hij zich kan voortbewegen. De straling kan ook door vacuüm heen, hierdoor wordt het mogelijk om deze straling van de zon hier op de aarde te ontvangen. (Dit in tegenstelling tot bijvoorbeeld geluid.)Een elektromagnetische golf is een elektrisch veld en een magnetisch veld die loodrecht op elkaar staan. λ is de golflengte.
Licht
Net als licht bestaat elektromagnetische straling uit fotonen. Fotonen kunnen zowel een golf als een deeltjeskarakter hebben. Golflengten tussen de 350 en 700 nm is zichtbaar licht voor ons. De energie die deze fotonen bevatten kunnen we uitrekenen met de volgende formule:Ef = hf = hc / λ (Wu = hf, met Wu als de uittree-arbeid/ uittree-energie
f is de frequentie in hertz. Frequentie is het aantal keren per tijdseenheid. In dit geval dus het aantal golflengtes per seconde. De h in de formule staat voor de constante van Planck:
6,62607 · 10-34 Js
De c in de formule staat voor de lichtsnelheid:
2,99792458 · 108 ms-1
Zo kunnen we dus uitrekenen hoeveel energie een foton dat licht is kan hebben:
Ef = hc / λ h = 6,62607 · 10-34 Js c = 2,99792458 · 108 ms-1 λ = 350 tot 700 nm (de n staat voor nano, betekend 10-9) (6,62607 · 10-34 · 2,99792458 · 108) / 350 = 5,68 · 10-28 (6,62607 · 10-34 · 2,99792458 · 108) / 700 = 2,84 · 10-28 Eflicht= 2,84 · 10-28 tot 5,68 · 10-28 J
Wat valt je op? Een kleinere golf bevat meer energie dan een grotere golf.