Het atoommodel van Bohr
 Niels Bohr leverde een inmense bijdrage aan de natuurkunde. In 1913 kwam hij met een theorie voor het atoommodel, waarin hij voortborduurde op het atoommodel van Rutherford. Het nieuwe model stelde dat elektronen die rondom de atoomkern cirkelen zich alleen in bepaalde banen met een vaste afstand tot de kern kunnen bevinden. Bij elk van deze banen hoort ook een specifieke energie. Bohr combineerde de theorie van Planck over kwantisering van straling met het model van Rutherford.
Niels Bohr leverde een inmense bijdrage aan de natuurkunde. In 1913 kwam hij met een theorie voor het atoommodel, waarin hij voortborduurde op het atoommodel van Rutherford. Het nieuwe model stelde dat elektronen die rondom de atoomkern cirkelen zich alleen in bepaalde banen met een vaste afstand tot de kern kunnen bevinden. Bij elk van deze banen hoort ook een specifieke energie. Bohr combineerde de theorie van Planck over kwantisering van straling met het model van Rutherford.Hoe men vroeger dacht
De oude Grieken bedachten het atomisme. Deze leer stelt dat alle materie is opgebouwd uit ontelbare ondeelbare deeltjes. A-tomos betekent letterlijk: onsnijdbaar. Men filosofeerde over de vraag of stoffen oneindig vaak deelbaar zijn of niet. Aangenomen dat materie niet oneindig vaak deelbaar zou zijn, dan zouden de 'overgebleven' deeltjes een grootte en een massa moeten hebben. De eerste die deze stelling aanhing was Democritus.Nadat de natuurwetenschappen in de renaissance tot grote bloei kwamen, kwam onderzoek naar materie weer onder de aandacht. De kleinste destijds bekende deeltjes werden in de 19de eeuw atomen genoemd. Later werd duidelijk dat deze deeltjes opgebouwd waren uit nog kleinere deeltjes.
Het atoommodel van Rutherford
De Nieuw Zeelandse natuurkundige Ernest Rutherford stelde in 1911 een atoommodel op dat gebaseerd was op een kleine positief geladen kern, waar een elektron omheen cirkelt (zie figuur 1). Hij was al in 1898 tot de conclusie gekomen dat de straling van radioactief materiaal uit twee soorten bestaat (alfa en bèta). Het was al bekend dat straling een dualistisch karakter heeft: het gedraagt zich niet alleen als golf maar ook als deeltje.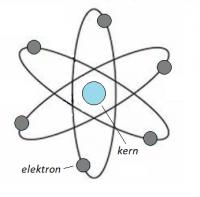 -fig 1- Atoommodel van Rutherford
-fig 1- Atoommodel van Rutherford- Atoom = orde van grootte 1 Ångström = 1 [A] = 10-10 [m],
- Atoomkern (nucleus) bevat vrijwel de gehele massa,
- Atoomkern is circa 10,000 keer zo klein als het atoom,
- Elektronen cirkelen rondom de kern.
De bezwaren tegen dit model konden als volgt worden samengevat:
- Het model is niet stabiel: het elektron zal terugvallen in de kern als het straling uitzendt (afgifte van energie)
- Het model levert geen verklaring voor het lijnenspectrum van licht (gebruik van een prisma).
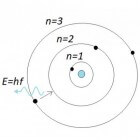
Het atoommodel van Bohr
In 1912 ging de Deense natuurkundige Bohr samenwerken met Rutherford. Door de kwantumtheorie van Max Planck te combineren met Rutherfords model ontstond het atoommodel van Bohr. De theorie vormt de grondslag voor de moderne kernfysica.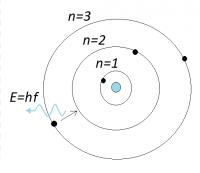 -fig 2- Atoommodel van Bohr
-fig 2- Atoommodel van Bohr- Een elektron kan zich steeds in bepaalde banen (met bepaalde energieën) bevinden.
- In stabiele toestand zit een elektron in de grondtoestand.
- Een elektron kan zich in een aangeslagen toestand bevinden (met hogere energie).
- Zo'n elektron valt terug naar de grondtoestand onder uitzending van straling.
De eerste stelling verklaart de stabiele toestand waarin een 'normaal' atoom zich bevindt: elektronen vallen niet terug naar de kern. Een aangeslagen toestand kan door verschillende oorzaken optreden, bijvoorbeeld door verhitting. Stel de energie in de grondtoestand is gelijk aan W1 en voor de aangeslagen toestand W2. Dan geldt voor de uitgezonden straling:
Een kwantum (energiepakketje) heeft een energie van:
- E = h x f = W2 - W1 = hc/λ
Met:
- h = constante van Planck = 6.625 x 10-34 [Js]
- f = stralingsfrequentie [Hz]
- λ = stralingsgolflengte [m]
- c = lichtsnelheid ≈ 3.0 x 108 [m/s]
Schillen
Wat betekenen die verschillende toestanden? Volgens het atoommodel van Bohr bevinden de elektronen van een atoom zich in een aantal schillen rondom de kern. Elke schil heeft zijn eigen energieniveau. Het aantal elektronen dat een schil kan bevatten is beperkt. De schillen worden als volgt gerangschikt (met toenemende afstand tot de kern):K, L, M, N, O, P en Q. Schilnummer 'n' bepaalt het maximaal aantal elektronen per schil:
- #elektronen,max = 2 x n2 (geldig t/m n=4)
De elektronen van een stabiel atoom gaan altijd in de schillen met de laagst mogelijke energie zitten.
Als voorbeeld kunnen we het Lithium-atoom bekijken. Lithium heeft 3 elektronen:
- De K-schil kan bevatten: 2x(1)2= 2 elektronen → 2 elektronen bezetten de schil, die dus vol is.
- De L-schil kan bevatten: 2x(2)2 = 8 elektronen → 1 elektron bezet deze schil.