Hoe zijn atomen opgebouwd?
Als we met een molecuulmodel een molecuul nabootsen, zien de atomen eruit als massieve bolletjes. Lange tijd werd gedacht dat ze er ook in het echt zo uitzagen, maar nu weten we dan atomen zijn opgebouwd uit protonen, neutronen, elektronen en een heleboel lege ruimte. Maar hoe zitten die kleinste deeltjes nou precies in elkaar?Moleculen, atomen en nog kleiner…
Dat materie uit atomen bestaat, is niet iets wat pas in de laatste eeuwen ter sprake is gekomen. De filosofen in het oude Griekenland vroegen zich al af of alles om zich heen deelbaar was in kleinere deeltjes. Bekende filosofen zoals Plato dachten van wel, en speculeerden al over het bestaan van atomen. Het woord atoom komt ook uit het Oud-Griekse woord atomos, wat ondeelbaar betekent.Alles wat we om ons heen zien – alle materie – is opgebouwd uit atomen. Een atoom is het kleinst herkenbare deeltje waaruit alle stoffen om ons heen zijn opgebouwd. Een groepje bepaalde atomen vormt een molecuul, bepaalde moleculen bij elkaar vormen elementen of stoffen. Het atoom is dus het kleinst herkenbare bouwsteentje, maar bezit nog wel alle eigenschappen van het element. Een gemiddeld atoom is 100 picometer, dat is 10 tot de macht -10 meter groot. Dit is zo verschrikkelijk klein dat een atoom zelfs onder een (gewone) microscoop met geen mogelijkheid te zien is. Lange tijd werd gedacht dat een atoom niet deelbaar was. Het atoom mag dan het kleinst herkenbare deeltje zijn, maar is niet het kleinste deeltje wat voorkomt. Een atoom is op te delen in protonen, neutronen en elektronen, maar dan verliest hij zijn kenmerkende eigenschappen. Tegenwoordig weten we dat zelfs de deeltjes uit een atoom op te delen zijn in quarks, maar voordat we dit ontdekten zijn vele wetenschappers ons voor gegaan. Hieronder de bekendste en belangrijkste atoommodellen op chronologische volgorde.
 Atoom volgens Dalton
Atoom volgens DaltonAtoommodel van Dalton
John Dalton (1776-1844) was de eerste wetenschapper die een atoommodel opstelde. Hij presenteerde zijn atoomtheorie in 1803. Hij was van mening dat alle materie opgesteld was uit atomen. Hij zag die atomen als kleine massieve bolletjes die bovendien ondeelbaar waren. Hij dacht ook dat alle atomen hun eigen kenmerkende eigenschappen en massa bezaten. Volgens hem bestonden de chemische elementen uit verschillende soorten atomen. Het beeld van atomen als massieve bolletjes heeft lang bestaan.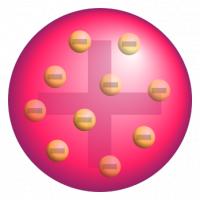 Atoom volgens Thomson / Bron: Publiek domein, Wikimedia Commons (PD)
Atoom volgens Thomson / Bron: Publiek domein, Wikimedia Commons (PD)Atoommodel van Thomson
Joseph John Thomson (1856-1940) was de eerste wetenschapper die ontdekte dat atomen niet ondeelbaar waren. Hij ontdekte de elektronen, negatief geladen deeltjes binnen in de atoom. Volgens Thomson zag een atoom er uit als een massieve, positief geladen bol met daarin hier en daar een elektron die vrij door de positieve massa kon bewegen. Hij beschreef zijn model als het “krentenbolmodel”: de elektronen in het atoom zijn als krenten in een bol deeg. Toen de wetenschapper Rutherford een tijdje later ontdekte dat een atoom ook een kern bevat, was dat het eind voor Thomsons atoomtheorie.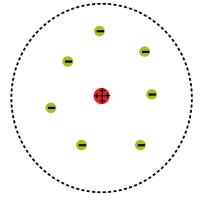 Atoom volgens Rutherford / Bron: Bensteele1995, Wikimedia Commons (CC BY-SA-3.0)
Atoom volgens Rutherford / Bron: Bensteele1995, Wikimedia Commons (CC BY-SA-3.0)Atoommodel van Rutherford
Ernest Rutherford (1871-1937) presenteerde in 1911 zijn atoommodel. Hij ontwikkelde deze aan de hand van een proef, waarbij hij de kernen van heliumatomen op goudfolie afschoot om te kijken of ze er doorheen gingen of terugkaatsten. Het grootste deel van de deeltje ging door het folie heen, maar een klein deel ketste af naar verschillende richtingen. Hieruit trok Rutherford de conclusie dat een atoom een kleine, zware, positief geladen kern bevat en dat de elektronen in een baan om de kern heen cirkelen. Tussen de kern en de elektronen zit een (relatief) zeer grote afstand van lege ruimte. Het beeld van een atoom is volgens Rutherford dus als volgt: de kern van de atoom bestaat uit positief geladen protonen, ongeladen neutronen en negatief geladen elektronen (elektronenwolk) die om de kern heen cirkelen op grote afstand. Dit idee van de bouw van een atoom wordt tot op heden als correct gezien. Rutherford stuitte wel op verschijnselen die hij niet kon verklaren, hier vond Niels Bohr oplossingen voor met zijn atoommodel.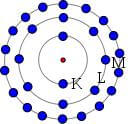 Atoom volgens Bohr / Bron: Cdang, Wikimedia Commons (CC BY-SA-3.0)
Atoom volgens Bohr / Bron: Cdang, Wikimedia Commons (CC BY-SA-3.0)Atoommodel van Bohr
Niels Bohr (1885-1962) bouwde verder op het atoommodel van Rutherford. Hij ontdekte dat de elektronen niet zomaar om de kern heen cirkelen, maar in schillen. Deze schillen hebben elk een bepaald aantal plekken vrij voor elektronen, en bootsen hierin de zogenaamde edelgassen na. De edelgassen hebben volle schillen, waardoor ze zeer stabiel zijn.De schillen zijn gerangschikt naar energieniveau. Hoe verder de schil naar buiten ligt, hoe meer plaatsen voor elektronen er zijn. Er zijn zeven schillen: K, L, M, N, O, P en Q, voorgesteld vanaf de kern naar buiten toe, die allemaal een maximaal aantal vrije plaatsen voor elektronen.
| Schil | K | L | M | N | O | P | Q |
|---|---|---|---|---|---|---|---|
| Rangnummer | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Max. bezetting | 2 | 8 | 18 | 32 | 32 | 32 | 32 |
Voorbeeld: We kijken naar het element chloor (Cl). Het chlooratoom heeft 17 protonen en 18 neutronen in de kern. Chloor heeft dus ook 17 elektronen in de elektronenwolk, anders zou het atoom geladen zijn. De eerste elektronenschil heeft dus 2 elektronen, de tweede 8, de derde 7. Er blijft dus nog maar één plekje, en dus bindingsplaats, over voor een elektron. Chloor heeft dus een covalentie van 1.