Wat is een zuur?
 In de reclame-wereld wordt vaak gesproken over de zuurgraad van produkten, of over het zuur in de maag. Maar wat is nou eigenlijk een zuur precies en zijn zuren altijd slecht?
In de reclame-wereld wordt vaak gesproken over de zuurgraad van produkten, of over het zuur in de maag. Maar wat is nou eigenlijk een zuur precies en zijn zuren altijd slecht?Alkanen, alkenen en alkynen
Een zuur is een eigenschap van een molecuul. Die eigenschap ligt vast in de structuur van de atomen. Er zijn een heleboel verschillende atomen die allemaal gerangschikt staan in het periodiek systeem der elementen, dat in 1869 door Mendelejev werd gemaakt. In die tijd waren nog helemaal niet alle elementen die nu bekend zijn, ontdekt. Het knappe van Mendelejev is dat hij op basis van de eigenschappen van de al wel bekende atomen, de ontbrekende kon voorspellen.Moleculen die voornamelijk uit de atomen koolstof (C ), zuurstof (O), stikstof (N) en waterstof (H) worden gemaakt, worden organische moleculen genoemd. Die moleculen die alleen uit een ketting van koolstof met waterstof bestaan, heten alkanen. De lengte van de keten van koolstofatomen bepaalt de naam. Zo is methaan korter dan ethaan, wat korter is dan propaan, wat weer korter is dan butaan en ga zo maar door met pentaan, hexaan, heptaan, octaan, nonaan en decaan enzovoorts.
Omdat ieder koolstofatoom vier bindingen naar andere atomen om zich heen moet hebben, is ieder koolstofatoom in de alkaanketting niet alleen aan zijn twee buur-koolstofatomen gebonden, maar ook aan twee waterstofatomen. Alleen de twee uiteindes van de ketting hebben drie waterstofatomen gebonden, aangezien ze maar aan één kant een koolstofatoom binden. Op deze manier kun je zelfs een formule opschrijven voor het aantal waterstofatomen in een alkaan. Die is namelijk gelijk aan 2 * het aantal koolstofatomen + 2. Soms klopt deze formule niet. Er zijn dan minder waterstofatomen dan er volgens de formule zouden moeten zijn. Er is dan een dubbele binding in het molecuul. Binnen de ketting van koolstofatomen en waterstofatomen zijn er twee waterstofatomen weggegaan, en omdat ieder koolstofatoom tóch vier bindingen om zich heen wil hebben, binden de twee verlaten C's dan maar een extra keer aan elkaar. Deze verbindingen heten alkenen, ethaan wordt etheen, propaan wordt propeen. Metheen bestaat niet, methaan heeft immers maar één C atoom en dan lukt een dubbele binding tussen twee koolstofatomen niet. Een driedubbele binding kan ook ontstaan, dan ontstaan de alkynen. Ethyn is hier een voorbeeld van.
De plaats waar de dubbele binding zit, wordt aangegeven met een getal. Er wordt dan geteld vanaf de kortste kant, zodat het laagste getal gebruikt wordt.
Bijvoorbeeld;
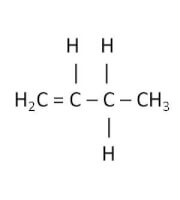 1-buteen
1-buteenAlcoholen en zuren
Maar dit stuk zou gaan over zuren. Wat is nou een zuur?Aan alkanen kunnen allerlei andere groepen vastgemaakt worden, zoals bijvoorbeeld een zuurstof die zelf weer vastzit aan een waterstof; OH. Dit maakt een alkaan een alcohol. Het alcohol dat in bier en andere dranken zit, is ethanol. Dit is ethaan, met een OH-groep.
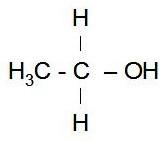 Ethanol
Ethanol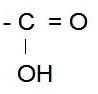
Omdat een zuurstofatoom altijd twee bindingen wil hebben, zit er een dubbele binding tussen het koolstofatoom en het zuurstofatoom. Als het zuurstofatoom aan een kant gebonden is aan een waterstofatoom, dan komt er geen dubbele binding voor; het zuurstofatoom heeft zijn gewenste twee bindingen, één keer met waterstof en één keer met koolstof.
Wat maakt dat een zuur een zuur is? Dat is de eigenschap dat het zijn H die aan de OH vast zit, heel makkelijk af kan staan. Doordat de overblijvende zuurstof wél twee keer wil binden, maar die dubbele binding niet met de overgebleven koolstof kan zijn – die is immers al vier keer gebonden, en wil niet vijf keer binden – blijft de tweede binding van het zuurstofatoom in de lucht hangen. Dit zorgt ervoor dat het zuurstofatoom negatief geladen wordt. Een negatief geladen deeltje kan reacties met positieve deeltjes aan gaan. In water (H2O) zal een azijnzuurmolekuul een waterstofatoom afstaan aan water. Er ontstaat dan een evenwicht, doordat andere, inmiddels negatief geladen azijnzuurmolekulen waterstofatomen van water opnemen. Dan kan de reaktie vergelijking worden opgesteld:

Sterke zuren, zwakke zuren
Sommige moleculen willen graag hun waterstofatoom kwijt, andere houden hem wat steviger vast. De eerste zijn sterke zuren, en er ontstaat dan veel H3O+. Als er veel onveranderd zuur in de oplossing blijft, dat dus zijn waterstofatomen goed vasthoudt, is het een zwak zuur.De ontvanger van het waterstofatoom in een zuur-reactie, wordt een base genoemd. In dit geval is water de base. Water kan echter ook een zuur zijn. Het staat dan een waterstof af, en er blijft OH- over.
De hoeveelheid H3O+ moleculen die zijn gevormd, zijn een maat voor de zuurgraad. Deze wordt met de term pH aangeduid. Van deze concentratie H3O+ wordt de logaritme berekend, en vermenigvuldigd met –1. Dit geeft de waarde voor de pH.
Stoffen met een pH van 7 zijn neutraal, als de pH lager is, is de stof zuur. De concentratie H3O+ moleculen is hoger, daardoor wordt de negatieve logaritme kleiner (0.001 of 10E(-3) is meer dan 0.0000001 of 10E(-7)). Als de pH tussen de 7 en 14 ligt, is een stof basisch. Dit wordt verwarrenderwijs ook wel alkalisch genoemd.
pH neutraal?
De pH van bloed van mensen is 7,41. Een kleine verandering is van grote invloed op de overleving van een individu. In de maag heerst echter een pH van 1 tot 4, in de darmen is het iets hoger, maar nog steeds zuur. En dat is maar goed ook, want veel bacteriën die het lichaam binnenkomen, kunnen niet goed tegen die lage pH en worden zo onschadelijk gemaakt.In de reclame wordt altijd gesproken over pH-neutraal, en dat dat het beste zou zijn. Maar soms is het dus helemaal niet zo'n goed idee om de pH neutraal te maken! Behalve uit het oogpunt van de bacteriën dan...