De corrosie van metalen
 Corrosie is metaal aantasting door chemische of elektrochemische reacties tussen metaal en elementen uit de omgeving. Meer dan een kwart van de wereld staalproductie is bestemd om constructies te vervangen die door corrosie verloren dreigen te gaan. Het Nederlands Corrosie Centrum in Zoetermeer schat de schade door corrosie op 17,5 miljard euro per jaar. Corrosie kan worden vertraagd door bij het ontwerp rekening te houden met de werkomgeving en vooral de constructiedetails. Corrosie voorkomen vraagt fundamentele kennis van metaal en het corrosieproces.
Corrosie is metaal aantasting door chemische of elektrochemische reacties tussen metaal en elementen uit de omgeving. Meer dan een kwart van de wereld staalproductie is bestemd om constructies te vervangen die door corrosie verloren dreigen te gaan. Het Nederlands Corrosie Centrum in Zoetermeer schat de schade door corrosie op 17,5 miljard euro per jaar. Corrosie kan worden vertraagd door bij het ontwerp rekening te houden met de werkomgeving en vooral de constructiedetails. Corrosie voorkomen vraagt fundamentele kennis van metaal en het corrosieproces.
Corrosie van metalen
- Meest voorkomende corrosie vormen
- Algemene chemische corrosie
- Het roesten van ijzer in een vochtig milieu
- Corrosie vormen
- Interkristallijne corrosie
- Spanningscorrosie met transkristallijne corrosie
- Contact corrosie
- Bestrijding galvanische corrosie
- Corrosiebestendigheid bevestigingsmaterialen
- Kathodische corrosie bescherming
- Samenvatting van bescherming van metalen tegen corrosie:
Meest voorkomende corrosie vormen
- Algemene corrosie gekenmerkt door een gelijkmatige chemische aantasting van het oppervlak door elementen uit de omgeving.
- Elektrochemische (galvanische corrosie). Corrosievorm treedt vaak plaatselijk op zijn:
- Spleetcorrosie
- Interkristallijne corrosie
- Spanningscorrosie (transkristallijne corrosie)
- Putcorrosie (pitting)
- Contact corrosie
- Ontzinken
- In de praktijk kunnen, afhankelijk van productvorm materialen, en milieu bovengenoemde corrosievormen naast elkaar voorkomen.
Algemene chemische corrosie
Onder algemene chemische corrosie verstaat men de omzetting van metaal in oxide, hydroxide of zout. Chemische corrosie treedt op wanneer metalen worden aangetast door chemische inwerking van bepaalde elementen. Het gehele metaaloppervlak wordt aangetast. De grootte van de aantasting wordt vastgelegd door gewichtsverlies per m2 per jaar (N/m2/jaar) of dikte afname (mm/jaar). Door geven van een corrosietoeslag op de dikte kan een bepaalde levensduur van het onderdeel afgedwongen worden.Walshuid en hamerslag: Droge oxidatie
Bijzondere (droge) chemische corrosie door zuurstof tijdens walsen en smeden van staal namelijk resp. blauwachtige walshuid en hamerslag (Fe3O4). Het zijn harde ijzeroxiden die tijdens het walsen en smeden worden geperst in het relatief zachte hete ijzer. Deze laag moet verwijderd worden voordat oppervlakte behandelingen als lakken, coaten of verzinken plaatsvinden omdat walshuid en hamerslag en daarmee de vroegtijdige oppervlakte behandeling na verloop van tijd afbladdert.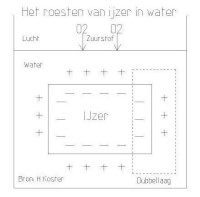
Het roesten van ijzer in een vochtig milieu
Het roesten van ijzer in een vochtig milieu is een elektrochemisch proces die plaats vindt op het oppervlak van ijzer. De reacties aan/op het ijzer oppervlak die het roesten van ijzer veroorzaken zijn:- Oplossen van positieve ijzer ionen (Fe2+)in het water waardoor op de grenslaag het water positief wordt( dat kan wegens de aard van de metaalbinding die bestaat uit ijzer ionen en vrije elektronen) volgens: Fe(s) → Fe2+(aq) +2e . De elektronen die blijven in het ijzer dat daardoor negatief wordt, er ontstaat een dubbellaag volgens de afbeelding.
- De zuurstof lost op in het water, volgens: 02+2H2O→4(OH)
- Vorming van poreuze ijzerhydroxide dat neerslaat, volgens: Fe+2(OH)→Fe(OH)2↓ , tenslotte 4Fe(OH)2 + O2 →2(FeO3)↓ + H2O ofwel geschreven in de eindvorm ijzerroest Fe2O3.n H2O.
- Er wordt door de vorming van ijzerhydroxide, ijzer en zuurstof onttrokken aan de dubbellaag, waardoor het evenwicht in de dubbellaag wordt verstoord en er opnieuw ijzer ionen en zuurstof in oplossing gaan. Dit proces gaat door omdat de ijzeroxide laag poreus is en het transport van ijzer ionen mogelijk blijft.
- Het ijzer wordt echter steeds negatiever door de achtergelaten elektronen waardoor steeds minder ionen het ijzer verlaten door de elektrische aantrekkingskracht van het negatieve ijzer op de positieve ijzer ionen aan het oppervlak. Er ontstaat een evenwicht. In dit geval zal de corrosie stoppen, maar in de praktijk zal het stuk ijzer contact maken met andere delen van de constructie. De overschot aan elektronen in het ijzer wordt dus afgevoerd en het roesten gaat door tot het stuk ijzer geheel weggeroest is, teruggekeerd tot zijn oervorm, namelijk ijzererts. Als de zuurstof opname in het water zou stoppen verlopen de genoemde reacties ook niet en stopt het roesten.
Corrosie vormen
 Roesten van het betonijzer heeft door uitzetting het beton van de rand gebroken / Bron: MADe, Wikimedia Commons (CC BY-SA-3.0)
Roesten van het betonijzer heeft door uitzetting het beton van de rand gebroken / Bron: MADe, Wikimedia Commons (CC BY-SA-3.0)Betonrot wordt veroorzaakt door het roesten van het betonijzer en dat roest mechanisme is dezelfde als behandeld in vorige paragraaf. Roest heeft een groter volume o.a. doordat het poreus is, dus bij het roesten van staal treedt volumevergroting op. Door het roesten van betonijzer in het beton wordt het beton uit elkaar gedrukt, betonrot genoemd. Dit gebeurt als het beton niet lucht en waterdicht is en er zuurstof en water bij het betonijzer kan komen en de voorgenoemde roest reacties plaatsvinden. De afbeelding toont een plek waar een stuk beton uitgesprongen is door uitzetting van het onderliggende betonijzer.
 Spleetcorrosie tussen buis en wand / Bron: Webcorr, Wikimedia Commons (CC BY-SA-3.0)
Spleetcorrosie tussen buis en wand / Bron: Webcorr, Wikimedia Commons (CC BY-SA-3.0)In een spleet in een metaal heeft vloeistof weinig uitwisseling met zuurstof in de vloeistof daarbuiten. Mede door capillaire werking treedt spleetcorrosie op vanaf spleten van een paar honderdste mm breedte. De volgende reacties treden in een spleet op:
Fe > Fe(2+) + 2e-
O2 + 2H2O + e > 4OH
In het microscheurtje raakt de zuurstof op en trekken de positieve metaalionen de negatieve chloorionen aan vanuit de elektrolyt (bijvoorbeeld zeewater) volgens:
Me+Cl + H2O > MeOH + HCl
Het zoutzuur (HCl) is sterk reducerend en tast het metaal aan in een direct chemische reactie. Deze corrosievorm is te voorkomen door spleten af te dichten. Bij roestvast staal zal het legeren met molybdeen (AISI Type 316) deze aantasting vertragen. Roestvaststaal T316 wordt veel toegepast als er contact is met zoutwater.
Spleetcorrosie komt veel voor bij producten in zeewater omdat dit elektrolyt goed geleidend is. Spleetcorrosie treedt op in spleten, zoals tussen bouten en moeren, tussen flenzen, onder vuilafzettingen. Spleetcorrosie kan snel fatale vormen aannemen. Het treedt vooral op in legeringen die zich passief gedragen zoals roestvaststaal in een milieu met agressieve ionen, zoals Chloor,
omdat door gebrek aan zuurstof in de spleet de aangetaste beschermende chroomoxide huid zich niet kan herstellen.
In een spleet waar zuurstof opname moeilijk is, ontstaat spleetcorrosie. Het betreft sluitringen, overlappende metaaloppervlakken of vuilaanslag op het metaal. Door onvoldoende zuurstof ontstaat geen (geoxideerde) passieve huid. Spleten moet afgedicht worden of zo wijd gemaakt dat het vocht in de spleet gemakkelijk kan worden uitgewisseld en er zuurstof bij kan komen. Roestvaste staalsoorten met een hoog chroomgehalte, in het bijzonder met een hoog molybdeen gehalte, zijn beter bestand tegen spleetcorrosie. Dat zijn de zeewater bestendige kwaliteiten Type 316, Type 316L en Type 316 Ti.
 Interkristllijne corrosie in austenitisch roestvaststaal / Bron: Antkyr, Wikimedia Commons (CC BY-SA-3.0)
Interkristllijne corrosie in austenitisch roestvaststaal / Bron: Antkyr, Wikimedia Commons (CC BY-SA-3.0)Interkristallijne corrosie
De interkristallijne corrosievorm komt voor bij austenitisch roestvast staal. Roestvast staal bevat in leveringstoestand koolstof die in het austeniet is opgelost. Bij verhitting (600 °C en 850 °C) verbindt koolstof zich met chroom tot chroomcarbiden die zich in/aan de korrelgrenzen uitscheiden omdat daar de ruimte is. Op de korrelgrenzen is het atoomrooster onregelmatig. Er ontbreken atomen (vacatures) Koolstof diffundeert naar de vacatures en bindt zich aan chroomatomen Hierdoor ontstaan chroomcarbiden. Het chroom wordt aan de grondmassa onttrokken, die plaatselijk chroom-arm wordt en daalt beneden 12%. Roestvast staal heeft minimaal 12% chroom nodig om een passieve chroomoxide-huid te vormen. De aantasting die hier het gevolg van is, wordt interkristallijne corrosie genoemd. De corrosie loopt langs de korrelgrenzen en een eventuele breuk ook. Chroomcarbiden vorming is afhankelijk van:- Chroom gehalte
- Koolstofgehalte
- Temperatuur
- Verblijftijd op die temperatuur
Interkristallijne corrosie voorkomen nadat reeds chroomverarming langs de korrelgrens optreedt
- Door homogeen gloeien bij ongeveer 900°C. De carbides blijven wel bestaan maar het chroom gebrek aan de korrelgrenzen wordt opgeheven door chroom diffusie van uit het midden van de kristallieten.
- Oplossend te gloeien bij 1050 °C - 1100°C en daarna afschrikken in water. Bij deze temperatuur lossen de chroomcarbiden op.
- We kunnen roestvast staal nemen met een extra laag koolstofgehalte (aanduiding L van low carbon) zodat zich geen carbides kunnen vormen of door het staal te stabiliseren door titanium, niobium, of tantalum toe te voegen (aangeduid met de toevoeging Ti, Nb of Ta) die vormen dan de carbides en er vindt geen ontchromen plaats.
 Schematische voorstelling van pitting (putcorrosie) / Bron: Cl Cu111, Wikimedia Commons (CC BY-SA-3.0)
Schematische voorstelling van pitting (putcorrosie) / Bron: Cl Cu111, Wikimedia Commons (CC BY-SA-3.0)Het corrosie mechanisme voor putcorrosie komt in grote lijnen overheen met die van spleetcorrosie. Putcorrosie is een plaatselijke corrosie, die optreedt wanneer in beschermende lagen beschadigingen voorkomen. De aanwezigheid van zeewater en industrie atmosfeer versnelt de putvorming. De "put" is een verraderlijke corrosievorm, vaak is aan de buitenkant weinig te zien, tot dat plotseling lekkage optreedt. De anodische elektronen stroom van passiveerbaar metaal (bijvoorbeeld RVS AISI 304), verandert in een Chloor-houdend milieu zodanig dat boven een bepaalde potentiaal, het passieve karakter van de beschermende oxidehuid stopt. Door de aanwezigheid van 2-3% Mo (AISI T316) blijft de passiviteit langer bewaard. Vandaar dat AISI T 316 (316L of 316Ti als er gelast wordt) beschouwd wordt als zeewaterbestendig roestvaststaal.
 Scheurvormende spanningscorrosie (SSC) in austenitische roestvaststaal in een chloorhoudend milieu. Scheuren lopen dwars doorheen de kristallieten / Bron: CEphoto, Wikimedia Commons (CC BY-SA-3.0)
Scheurvormende spanningscorrosie (SSC) in austenitische roestvaststaal in een chloorhoudend milieu. Scheuren lopen dwars doorheen de kristallieten / Bron: CEphoto, Wikimedia Commons (CC BY-SA-3.0)Spanningscorrosie met transkristallijne corrosie
SSC voorkomen door:- Spanningsarmgloeien of zachtgloeien om bewerkingsspanningen van lassen en andere bewerkingen te verminderen.
- Roestvaststaal type 304 vervangen door een hoog-nikkelhoudende legering of een hoog-chroomhoudend ferritisch roestvast staal of door speciale voor dit doel ontwikkelt duplex roestvast staal.
- Zuurstof- en chloor percentage in het milieu verminderen omdat de combinatie van deze elementen de SSC in austenitisch roestvast staal veroorzaken.
 Contact corrosie / Bron: D3j4vu, Wikimedia Commons (CC BY-SA-3.0)
Contact corrosie / Bron: D3j4vu, Wikimedia Commons (CC BY-SA-3.0)Contact corrosie
Contactcorrosie ontstaat dus door een elektronen geleidende verbinding tussen twee verschillende metalen in aanwezigheid van een geleidende vloeistof (elektrolyt, kan verontreinigd regenwater zijn). Van de minst edele, in dit voorbeeld zink elektrode(anode) lossen meer ionen Zn+ op dan Cu ionen van de edeler koperelektrode (kathode). De elektronen stromen van de zinkanode naar koperkathode waardoor het aantal elektronen in de zinkelektrode afneemt en weer Zn+ ionen in de elektrolyt oplossen enz.. Het koper blijft onaangetast.Ontzinken van messing
Onderdelen uit messing in contact met chloorhoudend water, tonen een corrosie vorm, waarbij de plaats koperrood wordt en het onderdeel ter plaatse zijn sterkte verliest. Deze corrosievorm noemt men ontzinken. Het is in feite contactcorrosie. Dus koper ionen en zinkionen lossen op. Het zink wordt afgevoerd, koper slaat weer op het moedermetaal neer (vandaar rode koperkleur ter plaatse).
Zelfs in één metaal ontstaat dus galvanische corrosie door potentiaalverschillen tussen de verschillende structuren. Dat is het geval bij messing waar het zink in de koperzink kristallieten in een warm vochtig tropische klimaat oplost door galvanische corrosie en het product uiteen valt.
Bestrijding galvanische corrosie
Galvanische corrosie is te voorkomen door metallisch contact te voorkomen tussen metalen met een duidelijk verschil in potentiaal. Deze corrosie treedt niet op als de beide metalen weinig potentiaalverschil hebben. Een koperen gevelplaat kan goed met roestvaststalen schroeven vastgezet worden maar niet met verzinkte stalen schroeven.Men kan oxidatie en reductie ruimtelijk scheiden en de uitwissel elektronen door een metalen geleider laten stromen. Elke oplossing vormt met het gedompelde metaal een halfcel. De beide halfcellen worden met een zoutbrug verbonden. Wanneer in de linker halfcel Zn+ in oplossing gaat, wordt de concentratie Zn+ ionen in oplossing groter. Tegelijkertijd ontstaat in de rechter oplossing een Cu+ ionen overschot. Ladingsevenwicht wordt via de zoutbrug hersteld.
Corrosiebestendigheid bevestigingsmaterialen
Bij de keuze van bevestigingsmaterialen speelt corrosie (atmosferische en galvanische) uiteraard een grote rol.Bevestigingsmaterialen in diverse corrosiebestendige materialen zoals verzinkt staal, aluminium, roestvast staal en Monel. (Monel is een nikkel-koper legering, die onder bepaalde omstandigheden beter corrosiebestendig is dan roestvast staal).
- Kies materiaal dat bestand is tegen de atmosfeer waarin het toegepast wordt.
- Kies voor het bevestigingsmateriaal hetzelfde materiaal of oppervlakte behandeling als de te bevestigen delen. Vooral als een geleidende vloeistof (of damp of condens) in de buurt kan komen.
- Wanneer verschillende materiaalsoorten wordt gebruikt, is het in geval 2 het beste de materialen van elkaar gescheiden door isoleren, door kunststof of een coating.
- Probeer combinaties waar het oppervlak van het minst edele metaal erg klein is te vermijden. De bevestiger is relatief klein en dus het zwakke punt van de constructie alle corrosie vormen kunnen zich ontwikkelen. Het bevestigingsmateriaal moet minimaal van het zelfde materiaal zijn of edeler.
Kathodische corrosie bescherming
Het galvanische oxidatieproces kan bewust gebruikt worden door delen die beschermd moeten worden te koppelen aan delen van een minder edel metaal en mogen corroderen. (Offerblokken)Als we de twee metalen kortsluiten en de stroom meten door de verbindingsdraad, zien we dat de corrosiesnelheid van koper afneemt en de corrosiesnelheid van zink toeneemt. De versnelde corrosie van het zink wordt veroorzaakt door de afvoer van elektronen.
De koper corrosie stopt, het koper wordt negatief en houdt oplossen van Cu ionen tegen. Het koper wordt dus beschermd tegen corrosie door zijn verbinding met zink. we noemen dit kathodische bescherming.
Grotere installaties zoals olietanks en pijpleidingen kunnen door een offerblok beschermd worden tegen galvanische corrosie. Het onedeler metaal bijvoorbeeld zink of magnesium wordt de anode en de tank wordt de kathode.
Op deze manier wordt de romp van zeeschepen door aangelaste zinkblokken tegen galvanische corrosie in zeewater beschermd. Ook het verzinken van carrosserieën valt onder kathodische corrosiebescherming.
Samenvatting van bescherming van metalen tegen corrosie:
- Passieveren van metaal waardoor aantasting van het oppervlak wordt voorkomen geschiedt door vorming van een dunne dichte oxidehuid. Stoffen die zuurstof afgeven kunnen een metaal passieveren, daarom wordt roestvaststaal soms gedompeld in salpeterzuur (daarna weer afgespoeld).
- De geleidende verbinding tussen de metalen wordt onderbroken door bijvoorbeeld isolerende Kunststof ringen tussen schroeven en te bevestigen metaal.
- De toegang van het (vocht) elektrolyt kan voorkomen worden door een beschermende coating. Elektrolytisch neergeslagen laag van een edeler metaal, of door epoxeren.
Lokaalelementen op microscopisch niveau
Deze galvanische elementen van edele en minder edelmetalen kan ook op microscopisch niveau, zoals wanneer een metalen verontreinigd is met andere. Onder bepaalde omstandigheden is zelfs niet nodig om het bestaan van twee verschillende metalen vast aan de voorwaarde voor een lokaal element, maar het is al voldoende dat een en hetzelfde metaal op verschillende punten een andere kristalstructuur of gedeeltelijk geoxideerd is.Complexer dan de corrosie van elementaire metalen is de corrosie bij legeringen. In een heterogene mengsel van kristallieten met verschillende samenstellingen, vormen zich lokaalelementen (micro-galvanische elementen).
Soms, wordt de corrosie afgeremd omdat zich een nieuwe beschermende laag vormt. Dit is het geval bij de legering van koper/ zink. Wanneer het onedele zink oplost, rekristaliseert het resterende koper zich en vormt een corrosiebestendige coating van Koperoxide.
Lees verder
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: Thester11, Wikimedia Commons (CC BY-SA-3.0)
- http://webhost.ua.ac.be/mitac4/tbw/tbw_cursus_h4.pdf*
- http://frontpage.waterscouting.com/corrosie-en-stalen-schepen/
- http://www.hommema.com/index.php/kathodische
- www.metaalmagazine.nl -1 2007
- http://www.onkenhout.nl/
- © 2010 GoLanTec | Oudenaardseweg 123 | B 9790 Wortegem-
- http://www.egbeck.de/chemkurs/skripten/cs11-28.htm
- KSC-Corrosion@mail.nasa.gov Kennedy Space Center : Corrosie Technology Laboratory
- http://members.upc.nl/w.jacobs20/corrosie/18%20pagina.htm
- http://www.kupferinstitut.de/front_fram ... inkung.pdf http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/11/aac/vorlesung/kap_11/vlus/korrosion.
- http://www.aljevragen.nl/sk/redox/RED015.html
- http://www.corrodium.nl/web/engineering/engineering_general_nl.htm
- http://www.homofaciens.de/technics-standard-electrode-potential_ge_navion.htm
- Afbeelding bron 1: Fir0002, Wikimedia Commons (GFDL-1.2)
- Afbeelding bron 2: Anna Frodesiak, Wikimedia Commons (CC0)
- Afbeelding bron 3: Eva K, Wikimedia Commons (GFDL-1.2)
- Afbeelding bron 4: MADe, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 5: Webcorr, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 6: Antkyr, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 7: Cl Cu111, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 8: CEphoto, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 9: D3j4vu, Wikimedia Commons (CC BY-SA-3.0)
Reacties
Wouter, 08-08-2017
Ik heb een vraag ik heb titanium pennen. Deze worden in een fabriek schoon gemaakt en opgestuurd. Ik doe hier een meting mee tussen twee plekken in een vloeistof.
Nou zie ik als ik de pennen extra schoon maak met alcohol dat de meting beter werkt. Ik denk dat dit komt omdat de pennen niet goed schoon zijn vanaf de Fabriek. De toeleverancier vertelt mij dat de pennen schoon zijn en dat dit de natuurlijke oxidatie laag is die er op natuurlijk wijze af gaat totdat het minimale aanwezig blijft.
Is er informatie over deze natuurlijk oxidatie laag en hoe snel is deze met normaal drink water te verwijderen? Misschien kan iemand mij hier mee helpen. Het web is vol info enkel de juiste vinden is niet altijd makkelijk.
Alvast bedankt groet wouter
Reactie infoteur, 09-08-2017
Wouter,
De titaanoxide laag is niet met water te verwijderen. Titaanoxide behoort tot de sterkste (stabielste) oxiden en is snel na verwijdering weer aanwezig. Het oppervlak van titanium en titaanoxide is op microschaal poreus dus nestelen zich verontreinigingen in de poriën en veranderen bijvoorbeeld de elektrische eigenschappen van het oppervlak. Het is denkbaar dat met alcohol een deel van die verontreinigingen tijdelijk oplost. Ook in schoon drinkwater bevinden zich volop verontreinigingen die zich in het titaan oppervlak nestelen. Uiteraard in gedestilleerd water minder. Deze eigenschap van het titaan oppervlak wordt benut bij titanium implantaten in het menselijk lichaam omdat weefsel in de poriën kruipt en het implantaat als het ware integreert in het lichaamsweefsel, een ideale oplossing als de patiënt niet allergisch is voor titanium wat zelden voorkomt. Dus Wouter blijven reinigen met alcohol of alternatief of (ik ken je meet doel niet) gedestilleerd water gebruiken.
J. Bultena, 25-06-2017
Waardoor worden gegalvaniseerde zinken golfplaten zwart?
Reactie infoteur, 08-07-2017
Gegalvaniseerde golfplaten worden donker (smerig) door verontreinigingen in de lucht.Het is eigenlijk niet de bedoeling verzinkte stalen golfplaten tegen aantasting te beschermen, het is immers al verzinkt om de levensduur te verlengen. De algemene manier om aantasting van metalen door verontreinigingen in de lucht (de belangrijkste veroorzakers van aantasting) te vertragen is reinigen met schoon water (hogedruk reiniger). Verder is belangrijk dat er geen beschadigingen zijn waardoor het onderliggende ijzer komt bloot te liggen. Let dus op de verbindingen want daar hopen verontreiningen zich op en treden bij onkundige montage beschadigingen op. Gebruik verzinkte stalen bevestigingsmaterialen om plaatselijke z.g.n contact-corrosie wegens contact tussen verschillende metalen te voorkomen. Volg de voorschriften van de fabrikant. De helft van de wereld staal productie wordt gebruikt om bestaande constructies die aangetast zijn door corrosie enz. te vervangen of te vernieuwen
M.Vr.G
Custor
Willem Doesburg, 15-02-2017
Er is een RVS 316 leiding waar een roodkoperen leiding tegen aan zit, kan hier door een bepaalde corrosie door ontstaan?
Reactie infoteur, 26-02-2017
Willem Doesburg,
In principe treedt hier bij aanwezigheid van een elektrolyt (dat is bij vocht al gauw het geval) contact-corrosie op. Aangezien het verschil tussen koper en roestvast staal elektrochemisch niet erg groot is zal de corrosie niet agressief en dus langzaam verlopen. Het is natuurlijk altijd beter een isolerende strip (kunststof plakband) aan te brengen tussen koper en roestvast staal.
M.Vr.Gr.
H Koster
Gerard Halsema, 01-12-2016
Ik heb een vraag over de toepassing van verzinkte 8.8 cilinderkop schroeven M3 in messing (CuZn39Pb3) producten.
Deze worden volautomatisch ingeschroefd tot aan de kop, op een vooraf ingesteld koppel.
Na productie word dit steekproefsgewijs gecontroleerd, en de schroeven zijn losneembaar met een koppel van +/- 30 Ncm.
Echter na opslag, transport en verwerking in een ander klimaat in een kunststof behuizing, is de schroef vast gaan zitten.
Wat kan hier de oorzaak van zijn?
Met vriendelijke groet,
Gerard
Reactie infoteur, 04-12-2016
Gerard,
De Corrosie-laag heeft een grotere volume als het moedermetaal. Indien zoals in uw geval de schroeven stevig aangedraaid worden is reeds weinig corrosie tussen zink en messing voldoende om de schroeven vast te zetten ("vastroesten").
M.Vr.Gr.
Custor
Hellus Honders, 29-10-2016
Kunt u mij vertellen en uitleggen waarom gegalvaniseerd koker profiel roest / weg roest op een cement/beton voet en open water en zuurstof?
Reactie infoteur, 30-11-2016
Hellus,
Van achter mijn bureau kan ik dat niet beoordelen. Het gaat om details. Uiteindelijk 'roesten' alle metalen weg, zelf roestvast staal, metalen willen allemaal terug naar hun erts toestand.
Het spijt me dat ik je niet verder kan helpen.
M.Vr.Gr.
Custor
Laatste update: 03-12-2016
Rubriek: Wetenschap
Subrubriek: Techniek
Bronnen en referenties: 23
 Algemene corrosie in een droog klimaat /
Algemene corrosie in een droog klimaat /  Corrosie in een vochtig klimaat /
Corrosie in een vochtig klimaat /  Blauwe hamerslag t.g.v. smeden en walsen /
Blauwe hamerslag t.g.v. smeden en walsen /