Elektronenconfiguratie: De mantel van het atoom
 Bohr verklaarde met zijn atoommodel in 1913 dat elektronen in de buitenste elektronenschil de chemische eigenschappen van een element bepalen. Bohr stelde zich de elektronenschillen voor als cirkelvormige schalen rond de atoomkern. Elke schil heeft een bepaald energieniveau ten opzichte van de kern, de binnenste schillen hebben een lager energieniveau dan de buitenste, dat houdt in dat elektronen in beginsel eerst de banen dicht bij de kern bezetten. De elektronen beïnvloeden elkaar echter vandaar dat er uitzonderingen bestaan op de regel dat de binnenste schillen het eerst helemaal gevuld worden. De beschrijving van de elektronenconfiguratie met de qauntummechanica valt buiten het bestek van dit artikel.
Bohr verklaarde met zijn atoommodel in 1913 dat elektronen in de buitenste elektronenschil de chemische eigenschappen van een element bepalen. Bohr stelde zich de elektronenschillen voor als cirkelvormige schalen rond de atoomkern. Elke schil heeft een bepaald energieniveau ten opzichte van de kern, de binnenste schillen hebben een lager energieniveau dan de buitenste, dat houdt in dat elektronen in beginsel eerst de banen dicht bij de kern bezetten. De elektronen beïnvloeden elkaar echter vandaar dat er uitzonderingen bestaan op de regel dat de binnenste schillen het eerst helemaal gevuld worden. De beschrijving van de elektronenconfiguratie met de qauntummechanica valt buiten het bestek van dit artikel.
Het neutrale atoom
Het massagetal (A) is het totale aantal protonen en neutronen (som der nucleonen) in een atoomkern. Atoomnummer (Z) is het aantal protonen in de kern. Het verschil tussen het massagetal en atoomnummer geeft het aantal neutronen (N) in een bepaalde nucleus. N = A - ZVoor een neutraal atoom geldt:
Atoomnummer Z = Aantal protonen = Aantal elektronen
Aantal neutronen N = Massagetal A (totaal aantal nucleonen) - Atoomnummer Z (aantal protonen)
Elektronenconfiguratie
De elektronenconfiguratie van een atoom geeft de verdeling weer van de elektronen over de verschillende hoofdschillen en subschillen (banen) rond de atoomkern. De elektronenconfiguratie tabel laat zien hoeveel elektronen(banen) er in elk energieniveau n zitten en de verdeling van de elektronen over de subschillen.Elektronenconfiguratie tabel
Als voorbeeld neemt men het goudatoom. s, p, d, f zijn de subschillen (baantypen) binnen de energieniveaus n = 2, 3, 4, 5, 6. Het totale aantal elektronen per energieniveau is de som van de elektronen in de subschillen van dat energieniveau n. Het aantal elektronen per energieniveau 1 t/m 6 in een goudatoom is in onderstaande tabel weergegeven. Het maximum aantal elektronen dat een energieniveau kan bezetten wordt gevonden met de formule 2n², waarin n het hoofdquantum getal. De verschillende stabiele elektronenbanen worden bepaald door het golfkarakter van de elektronbeweging, waarbij de golflengte λ wordt bepaald door λ=h/mv, waarin h de constante van Planc, m de massa van het elektron en v zijn baansnelheid. Omdat de baanomtrek gedeeld door de golflengte een geheel getal is, kunnen zich alleen bepaalde banen instellen.| n | s | p | d | f | Goud: Aantal elektronen op energieniveau n | Goud: Maximaal aantal elektronen op energieniveau n = 2n2 |
|---|---|---|---|---|---|---|
| 1 | 1s2 | --- | --- | --- | 2 | 2 |
| 2 | 2s2 | 2p6 | --- | --- | 8 | 8 |
| 3 | 3s2 | 3p6 | 3d10 | -- | 18 | 18 |
| 4 | 4s2 | 4p6 | 4d10 | 4f14 | 32 | 32 |
| 5 | 5s2 | 5p6 | 5d10 | --- | 18 | 50 |
| 6 | 6s1 | --- | --- | --- | 1 | 72 |
 Bron: Roshan220195, Wikimedia Commons (CC BY-SA-3.0)
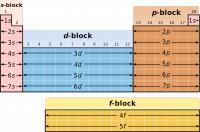
Bron: Roshan220195, Wikimedia Commons (CC BY-SA-3.0)Blokken in periodiek systeem
Het type blok verwijst naar het baantype dat wordt gevuld met valentie-elektronen. De blokken zijn:- s-blok
- p-blok
- d-blok
- f-blok
De chemische eigenschappen, d.w.z. het gedrag van atomen uit hetzelfde blok vertonen duidelijke overeenkomsten. De chemische eigenschappen van de atomen worden namelijk grotendeels bepaald door de buitenelektronen (valentie-elektronen).
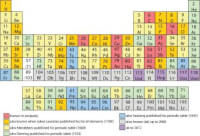
Elektronegativiteit volgens de Paulingschaal
Elektronegativiteit is een maat voor de bereidheid van een atoom om elektronen van buiten aan te trekken. Elementen aan de rechterkant van het periodiek systeem zijn elektronegatief (2,5-4) en die aan de linkerkant zijn elektropositief (0,8-1,5)t.o.v. de atomen van de rechterkant.Elektronenaffiniteit
De elektronenaffiniteit van atoom of molecuul is de vrijkomende energie bij de opname van een elektron door een neutraal atoom. Positieve elektronenaffiniteit betekent dat er energie vrijkomt bij de overgang van atoom naar anion. (anion is een negatief geladen ion, het atoom vangt dus een elektron in en de kinetische energie van dat elektron is de energie toename). Chloor trekt het sterkst een extra elektron aan en kwik trekt het zwakst een extra elektron aan. De elektronenaffiniteit van edelgassen is ongeveer 0. Niet-metalen hebben door de bank genomen een grotere elektronenaffiniteit dan metalen.Ionisatiepotentiaal
De ionisatiepotentiaal of -energie is een maat voor de bindingsenergie van een elektron aan het atoom en dat is de energie die nodig is om uit een vrij atoom een elektron te stoten. Ionisatiepotentiaal in volts, of ionisatie-energie in Joule of elektronvolt, of molaire ionisatie-energie (Joule per mol).De ionisatiepotentialen van de elementen tonen de periodieke structuur van de atoomopbouw met zijn regelmatig terugkerende elektronenconfiguraties, volgens grafiek eV=Functie(Z). Edelgassen met hun volledig gevulde schillen hebben de hoogste potentialen en alkalimetalen de laagste.
 Bron: Sandbh, Wikimedia Commons (CC BY-SA-3.0)
Bron: Sandbh, Wikimedia Commons (CC BY-SA-3.0) Bron: PNG: w:de:user:Kiko2000; SVG: Cepheiden, Wikimedia Commons (CC BY-SA-3.0)
Bron: PNG: w:de:user:Kiko2000; SVG: Cepheiden, Wikimedia Commons (CC BY-SA-3.0)Nawoord met betrekking tot de quantummechanica
In voorgaande is het atoom vereenvoudig tot het Bohrmodel. In werkelijkheid zijn de elektronenbanen niet eenduidig cirkel- en ellipsvormig zoals in een planetenstelsel. In werkelijkheid is er sprake van een wolk waar de beweging van een elektron niet aan te geven is, maar gesproken wordt in termen van waarschijnlijkheid wat snelheid, richting en plaats van een elektron in de wolk betreft. De eigenschappen van de elektronenwolk wordt heden beschreven met de quantummechanica. De quantummechanische beschrijving van de elektronenconfiguratie valt buiten het bestek van dit artikel en behandeld in een apart hoofdartikel.Lees verder
© 2015 - 2024 Custor, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Wat is ionisatie?Waaruit bestaat een atoom? Wat is een proton, elektron en neutron? Wat is de lading en massa van deze deeltjes? Wat is i…
Wat is ionisatie?Waaruit bestaat een atoom? Wat is een proton, elektron en neutron? Wat is de lading en massa van deze deeltjes? Wat is i…
 Elektronconfiguratie opstellen - theorie en voorbeeldenAlle elementen in het periodieke systeem der elementen beschikken over een aantal protonen. Zo zit er in een waterstofke…
Elektronconfiguratie opstellen - theorie en voorbeeldenAlle elementen in het periodieke systeem der elementen beschikken over een aantal protonen. Zo zit er in een waterstofke…
 De 3 soorten stoffen (chemie)Er zijn 3 soorten stoffen vanuit de chemie: moleculaire stoffen, zouten en metalen. Hieronder staan alle drie de soorten…
De 3 soorten stoffen (chemie)Er zijn 3 soorten stoffen vanuit de chemie: moleculaire stoffen, zouten en metalen. Hieronder staan alle drie de soorten…
Gerelateerde artikelen
Hoe is een atoom opgebouwd?Een atoom, het kleinste bouwsteentje van elk element dat we kennen. Vrijwel alle eigenschappen van de materie op de were…
Veilig gebruik en toepassingen van droogijsDroogijs is eigenlijk een vorm van koolstofdioxide (CO2) waarbij de gasvormige aggregatietoestand bij een temperatuur va…
De eigenschappen van metalen verklaard door de metaalbindingHet grootste gedeelte van het periodieke systeem der elementen bestaat uit metalen. Opvallend aan metalen is dat ze in z…
Bronnen en referenties
- Inleidingsfoto: Greg Robson / RAM, Wikimedia Commons (CC BY-SA-2.0)
- http://education.jlab.org/qa/electron_config.htm
- http://nl.wikipedia.org/wiki/Ionisatiepotentiaal
- http://nl.wikipedia.org/wiki/Elektronenaffiniteit
- http://education.jlab.org/qa/pen_number.html
- http://nl.wikipedia.org/wiki/Elektronegativiteit
- http://slideplayer.nl/slide/2259939/
- http://nl.swewe.net/word_show.htm/?35486_1&Ionisatiepotentiaal
- http://www.staff.science.uu.nl/~hoekz103/wwwpmn/05-06/ppp25.htm(tekening lymann reeks enz.)
- Afbeelding bron 1: Roshan220195, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 2: Sponk, Wikimedia Commons (CC BY-3.0)
- Afbeelding bron 3: Sandbh, Wikimedia Commons (CC BY-SA-3.0)
- Afbeelding bron 4: PNG: w:de:user:Kiko2000; SVG: Cepheiden, Wikimedia Commons (CC BY-SA-3.0)
Custor (173 artikelen)
Laatste update: 13-12-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 13
Laatste update: 13-12-2016
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 13
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.
