De eigenschappen van metalen verklaard door de metaalbinding
Het grootste gedeelte van het periodieke systeem der elementen bestaat uit metalen. Opvallend aan metalen is dat ze in zuivere vorm enkele overeenkomsten hebben. Het zijn goede geleiders van warmte en elektriciteit, ze zijn in makkelijk vervormbaar en hebben een glimmend uiterlijk. De metaalbinding speelt hierin een belangrijke rol. In dit artikel wordt vanuit het elektronenzee-model gekeken hoe de eigenschappen van metalen te verklaren zijn.Metaalrooster
De positief geladen kern van een atoom oefent een aantrekkingskracht uit op de elektronen in de elektronenwolk om het atoom. In metalen is de aantrekkingskracht tussen de kern en de elektronen in de buitenste schil echter klein. Het gevolg hiervan is dat de buitenste elektronen zich tamelijk vrij kunnen bewegen tussen de verschillende metaalatomen. Het idee is dat de metalen een metaalrooster vormen van positief geladen elektronen met daaromheen vrij bewegende elektronen. Het elektronenzee-model is een manier om het voor te stellen.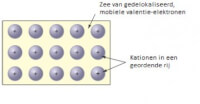 Het rooster van positief geladen metaalionen omgeven door vrij bewegende elektronen. (McMurry et al., 2012, p. 860)
Het rooster van positief geladen metaalionen omgeven door vrij bewegende elektronen. (McMurry et al., 2012, p. 860)Geleiding
Omdat de elektronen zich vrij om de atomen kunnen bewegen, zijn het goede geleiders van elektrische stroom en warmte. Door een positief geladen voorwerp naast een metaal te houden, zullen de elektronen door de aantrekkingskracht zich gaan bewegen naar het voorwerp, waardoor het voorwerp aan een kant negatief en aan de andere kant positief geladen wordt. Isolatoren hebben juist de eigenschap dat elektronen moeilijk kunnen bewegen. Voor het geleiden van stroom is het een voorwaarde dat elektronen kunnen bewegen.De elektronen zijn ook in staat om warmte mee te nemen. In die zin is stroming en niet geleiding de juiste vorm van warmteoverdracht in metalen.
Vervorming van metalen
Metalen zijn buigzaam, goed vervormbaar en goed kneedbaar. Daardoor kunnen ze worden vormgegeven tot draden en dunne platen. Bij het verplaatsen van de metaalionen in het rooster, door bijvoorbeeld op het metaal te slaan met een hamer, bewegen de vrije elektronen mee. Daardoor verandert het metaal niet van samenstelling. Metaal kan dus worden vervormd tot vormen als draden platen zonder dat daarmee de metaalbinding verloren gaat.Uiterlijk
Metalen zijn in zuivere vorm allemaal glimmend van uiterlijk. De edele metalen blijven glimmen, mits ze goed gepoetst worden. Metalen als koper en goud gaan in zuivere vorm geen reacties aan met andere stoffen, dus vindt er geen aantasting van het uiterlijk plaats. Dat verandert naarmate metalen onedeler worden. Een zeer onedel metaal als cesium en kalium reageert vrijwel meteen met zuurstof uit de lucht, waardoor het oppervlak dof wordt.Smelt- en kookpunt
De smeltpunten van metalen variëren enorm. Zo zijn alkalimetalen zacht en smelten ze al op lage temperaturen. Het smeltpunt van natrium is 98 °C en van cesium zelfs 28,5 °C. Aan de andere kant heeft wolfraam een heel hoog smeltpunt van 3422 °C. Van alle elementen heeft alleen koolstof een hoger smeltpunt. Het kookpunt van wolfraam is zelfs 5828 °C. Dit verschil in smeltpunten heeft met name te maken met de hoeveelheid elektronen in de buitenste schil.Door de vormgeving van de metaalbinding is de binding ook bijzonder sterk in de vloeibare vorm. De metaalionen kunnen dan ten opzichte van elkaar bewegen, maar de elektronenzee blijft intact. Deze vrije elektronen zorgen ervoor dat de metaalionen onverminderd sterk bij elkaar blijven. Een goed voorbeeld daarvan is het metaal gallium. Het heeft een laag smeltpunt van 29,8 °C, maar het kookpunt ligt weer hoog: 2204 °C. Een temperatuur vergelijkbaar met het kookpunt van koper (2562 °C). Een uitzondering hierop vormt de zinkgroep, met relatief lage kookpunten.