Radioactiviteit en de mens
 Men spreekt van radioactieve stralen (radio=straling), dit moet ioniserende straling zijn, niet de straling is radioactief maar de bron. De radioactieve bron bestaat uit instabiele atomen, de atoomkernen zijn niet in evenwicht door een scheve verhouding tussen protonen en neutronen. Door uitstralen van materie en energie wil de atoomkern zijn evenwicht herstellen. Er zijn meerdere soorten straling: alfa -, bèta -, gamma -, neutronen -, en röntgenstraling. De straling maakt door botsing in andere atomen elektronen vrij (ionisatie). Radioactiviteit is een natuurlijke proces, waarbij ioniserende straling vrijkomt die zoveel energie heeft dat ze verandering in andere atomen veroorzaakt. Onze omgeving zit vol ioniserende straling, zowel binnen- als buitenshuis.
Men spreekt van radioactieve stralen (radio=straling), dit moet ioniserende straling zijn, niet de straling is radioactief maar de bron. De radioactieve bron bestaat uit instabiele atomen, de atoomkernen zijn niet in evenwicht door een scheve verhouding tussen protonen en neutronen. Door uitstralen van materie en energie wil de atoomkern zijn evenwicht herstellen. Er zijn meerdere soorten straling: alfa -, bèta -, gamma -, neutronen -, en röntgenstraling. De straling maakt door botsing in andere atomen elektronen vrij (ionisatie). Radioactiviteit is een natuurlijke proces, waarbij ioniserende straling vrijkomt die zoveel energie heeft dat ze verandering in andere atomen veroorzaakt. Onze omgeving zit vol ioniserende straling, zowel binnen- als buitenshuis.Radioactiviteit en radio-isotopen
Isotopen zijn atomen van hetzelfde element met een verschillende opbouw van de atoomkern (verschillend aantal neutronen). Vrijwel alle elementen - ook in de natuur - hebben isotopen. De eigenschappen van een atoom worden bepaald door het atoomnummer en dat is per definitie het aantal protonen. Het is moeilijk isotopen van hetzelfde element met chemische middelen te onderscheidenvan elkaar te scheiden. Isotopen van hetzelfde element hebben hetzelfde atoomnummer maar een verschillend massagetal (atoommassa). Vanaf atoomnummer 20 is het aantal neutronen van isotopen groter dan het aantal protonen van het element.Elementen zijn een mengsel van isotopen. Bijvoorbeeld chloor heeft atoomnummer 17. Alle chlooratomen hebben dus 17 protonen in de kern, er zijn twee isotopen, namelijk met 18 neutronen en 20 neutronen. Het massagetal van de beide isotopen is dus 17 + 18 = 35 of 17 en 17 + 20 = 37. De eenvoudigste codering van de twee isotopen is Cl-35 en Cl-37. Het aantal protonen en neutronen hoeft men niet apart vermeld te worden, immers chloor heeft atoomnummer 17 en heeft dus 17 protonen, dus is aantal neutronen bekend als het massagetal bekend is.
Van elk element bestaan atomen die een afwijkend aantal nucleonen in de kern hebben en daarom niet in evenwicht zijn, de isotopen. Deze isotopen zijn dus niet stabiel en veranderen langzaam of snel, afhankelijk van hun stabiliteit, door het uitzenden van protonen, neutronen, of elektromagnetische golven. Dat zijn de zogenaamde radio-isotopen. Door het radioactief verval van de radio- isotopen ontstaan tenslotte stabiele atomen die vaak een ander element zijn dan het uitgangs-element. Radioactiviteit is dus niets anders als het uitzenden van 'overtollige' deeltjes uit de atoomkern. De gevaarlijkste straling bestaat uit elektromagnetische golven wegens hun grote doordringingsvermogen, zoals de röntgenstralen.
Soorten straling
De radioactieve bron kan vaste stof, vloeistof, damp of gas zijn. Voorbeelden van radioactieve stoffen zijn: Uranium, plutonium. Radium, kobalt, Cesium, en jodium. Straling kun je niet zintuiglijk waarnemen. Atomen kunnen vier soorten straling uitzenden. Alfa-, bèta-, gamma-, rontgen en neutronen straling. Straling wordt gevaarlijk als ze cellen of DNA kan beschadigen, dat kan kanker inleiden. We bestaan voor het grootste gedeelte uit water en wanneer straling opbotst tegen water en geabsorbeerd is er niets aan de hand. Het lichaam repareert zelf de meeste schade aan de DNA.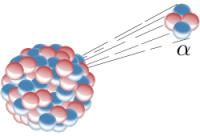 Bron: Inductiveload, Wikimedia Commons (Publiek domein)
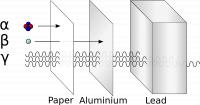
Bron: Inductiveload, Wikimedia Commons (Publiek domein)Alfastraling, bestaat uit helium kernen (2 protonen en 2 neutronen) uitgestoten door onstabiele atoomkernen. Alfastraling heeft een gering doordringend vermogen. Een blad papier en kleding is voldoende om alfastraling tegen te houden. Het kan niet door de huid heen dringen en komt, indien radioactief stof wordt ingeademd, niet verder dan het longslijmvlies, waar ze schade kan veroorzaken. Alfa deeltjes vliegen met 16.000 km per seconde uit de atoomkern. Alfastraling wordt o.a. uitgezonden door radioactief gas radon dat vrijkomt uit de bodem, uit bouwmaterialen en uit plutonium. De uranium kern kan zo’n helium kern uitstoten. Het uranium verandert dan in thorium (Th). Alfastraling is het grootste radioactieve deeltje. Als het tegen een lichaam cel opbotst zal het schade opleveren, maar het komt niet diep in het lichaam.
 Bron: Inductiveload, Wikimedia Commons (Publiek domein)
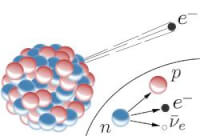
Bron: Inductiveload, Wikimedia Commons (Publiek domein)Béta straling zijn elektronen, uit het atoom weggeslingerd met 270.000 km per seconde. Doordringend vermogen is sterker dan van alfastraling. Ze worden tegengehouden door een aluminiumplaat van 3mm of door 3 meter lucht. Béta straling wordt uitgezonden door o.a radioactieve strontium-90. In de bèta-straler zelf wordt in de kern een neutron in een proton omgezet onder uitstoting van een elektron. Het verandert daardoor zelf in een ander element. Bètastraling is gevaarlijker dan alfastraling, want deze straling bestaat uit kleinere deeltjes die dieper je lichaam doordringen. Het kan tussen cellen doorglippen, maar per botsing levert bètastraling, als klein deeltje, (het is bijna 2000 maal lichter als een proton) minder schade op.
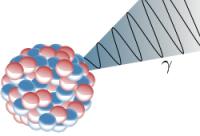 Gammastralen ontsnappen uit een atoomkern / Bron: Inductiveload, Wikimedia Commons (Publiek domein)
Gammastralen ontsnappen uit een atoomkern / Bron: Inductiveload, Wikimedia Commons (Publiek domein)Bij verval van een radioactieve bron wordt vaak gammastralen uitgezonden, het zijn evenals zichtbaar licht elektromagnetische golven die zich verplaatsen met lichtsnelheid. Gammastralen dringen ver door in materiaal, ze worden tegengehouden door materialen als ijzer, beton en lood waarvan de dikte wordt bepaald door de intensiteit der straling. Gammastraling komt bij alle radioactieve processen meestal in beperkte hoeveelheid vrij. Het is de gevaarlijkste straling, omdat deze straling veel energie heeft, kan hij makkelijk onze lichaamscellen diep in ons lichaam beschadigen. Gammastraling kan door ons lichaam heen vliegen en niets vernielen, maar bij botsingen ernstige schade aan bijvoorbeeld DNA toebrengen. Gammastraling wordt o.a uitgezonden door barium-137, het radioactieve vervalproduct van cesium-137.
 Wilhelm C Röntgen 1845-1923
Wilhelm C Röntgen 1845-1923Röntgenstraling, ook X stralen genoemd is, als gammastralen en zichtbaar licht, een elektromagnetische straling en wordt kunstmatig opgewekt in een röntgenbuis. Ze heeft een veel hogere energie dan licht, golflengte (0,01nm- 4,5nm) en energie liggen tussen UV licht en gammastralen en dringt diep in ons lichaam door. Röntgenstralen worden gebruikt voor het maken van röntgenfoto's. Röntgen is de uitvinder van de röntgenstralen en daarmee de grondlegger van de diagnostische radiologie, dat wil zeggen, het stellen van een diagnose met behulp van beelden.
Neutronenstraling
Neutronen kunnen andere atomen in het lichaam radioactief maken en die atomen zullen weer alfa-, bèta- of gammastraling uitzenden. Des te sneller de neutronen des te dieper dringen ze in het lichaam door en maken er atomen instabiel dus radioactief. Op de neutronenstraling is de werking van de kernreactor en de atoombom gebaseerd.
Het meten van straling
We bepalen met becquerel hoeveel atomen vervallen, dat getal zegt niets over de schade. Hoe gevaarlijk een stof is wordt bepaald door:1) hoeveel atomen vervallen per tijdseenheid (Becquerel). 2) welke soort straling komt vrij. 3) hoeveel (kinetische)energie heeft de straling (Gray) 4) de gevoeligheid (van het weefsel) voor de soort straling. De eenheid die zich richt op schade bij de mens is de sievert.Een dosis straling kan schade veroorzaken aan DNA. Als gevolg van deze verandering (mutatie) in het DNA kan zich in een later stadium kanker ontwikkelen (bijvoorbeeld leukemie en schildklier kanker) of misvorming in het nageslacht.. Het lichaam herstelt de schade vaak zelf. Bij een hoge dosis straling ontstaan brandwonden en misselijkheid. Het gevaar van straling hangt van de dosis af. Vergelijk radioactief materiaal met een hagelbui, aantal hagelstenen wordt gemeten in Becquerel. De energie die de stenen overbrengen op een voetganger wordt uitgedrukt in Gray en de schade die ze bij de persoon veroorzaken in Sievert.
 Henri Becquerel 1852-1908
Henri Becquerel 1852-1908Eenheid van radioactief verval; 1 becquerel (naar de Franse fysicus Henri Becquerel) wil zeggen dat er iedere seconde 1 atoom vervalt. Het is een maat voor radioactiviteit in voedsel, lucht en water. Zeewater heeft een radioactiviteit van ongeveer 12 Bq per liter. Radioactiviteit van ons lichaam is circa 120 Bq per kilogram. In een volwassen mens vervallen circa 10.000 atomen per seconde. De radioactiviteit hangt af van de massa van de radioactieve bron en de halveringstijd. des te korter de halvevingstijd, des te intensiever de straling.
Becquerel zegt niets over gevaar. Wanneer een atoom vervalt kan het verschillende soorten stralen uitzenden. De ene straling is gevaarlijker dan een andere. De becquerel zegt alleen hoeveel atomen er vervallen, niet hoeveel straling die atomen uitzenden, ook niet de soort straling en hoe gevaarlijk die is, het gevaar wordt mede bepaald door de afstand tot de bron en de gevoeligheid van het weefsel.
 Lois H Gray-1905-1965
Lois H Gray-1905-1965Ioniserende straling draagt energie over op lichaamweefsel. De geabsorbeerde dosis wordt vastgelegd in Gray; 1 Gray komt overeen met 1 joule per kilo. De Gray (Gy) zegt alleen iets over het natuurkundige effect. De naam Gray is afkomstig van Gray, een Britse natuurkundige). Gray (Gy), eenheid van hoeveelheid geabsorbeerde ioniserende straling. 1 gray is de absorptie van een Joule (=1Nm) stralingenergie door een kilogram materie. 1 Gy = 1 J/kg
 Rolf Sievert 1896-1965
Rolf Sievert 1896-1965Sievert is de maat voor het biologisch effect (schade) die afhankelijk is van de soort straling en het soort weefsel dat wordt bestraald. 1 dosis van 10 tot 20 gray is dodelijk voor een mens (stralingsziekte), hieruit berekenen we dat het overeenkomt met circa 1000 joules (Nm) voor een volwassen persoon van circa 75 kg.
De sievert, genoemd naar de Zweedse arts Sievert, is een maat voor mogelijke gezondheidsschade. Alfa-, béta- en gammastraling hebben een verschillende uitwerking. Meestal wordt gewerkt met millisievert (een duizendste sievert). De sievert zegt iets over de schade die een radioactieve stof bij de mens kan veroorzaken De meest radioactieve stof is niet altijd het gevaarlijkst. Hoe hoger de sievert hoe groter de kans op biologische schade.
Elke soort straling heeft bij de sievert een vermenigvuldigingsfactor de zgn. kwaliteitsfactor. Snelle neutronen zijn gevaarlijker dan langzame neutronen. Bij snelle neutronen , wordt de straling, wegens gevaar van grotere schade, met 20 vermenigvuldigd. Er zijn voor alle stralingssoorten bij verschillende energieën andere kwaliteit factoren. De sievert houdt rekening met de afstand tot de bron en welk deel van het lichaam bestraald wordt. Kans op bijvoorbeeld kanker in de organen is groter dan de kans op botkanker, bij dezelfde straling. Zo ontstaat een beeld (een gevarenkaart) van de individuele z.g.n. effectieve stralingsdosis die iemand heeft ontvangen gedurende een bepaalde periode.
 Waarschuwing voor een radioactiviteit niveau die voor de mens gevaarlijk is / Bron: Cary Bass, Wikimedia Commons (Publiek domein)
Waarschuwing voor een radioactiviteit niveau die voor de mens gevaarlijk is / Bron: Cary Bass, Wikimedia Commons (Publiek domein)Het stralingsgevaar
Eenheden1Sv 10↑3 millisievert mSv
1Sv 10↑6 microsievert µSv
1Sv 10↑9 nannosievert nSv
Gevaar op korte termijn
| millisievert | Sievert | gevolgen op korte termijn |
|---|---|---|
| 0-250 | 0-0,25 Sv | geen merkbare gevolgen |
| 250-1000 | 0,25-1,0 | misselijkheid; eerste schade aan beenmerg, lymfeklieren en milt |
| 1000-3000 | 1,0-3,0 | misselijk en braken, eetlust neemt af; meer schade aan genoemde organen. Dit kan je nog te boven komen |
| 3000-6000 | 3,0-6,0 | heftige misselijkheid en braken, geen eetlust, bloedingen, brandwonden, eerste gevallen van dood op korte termijn |
| 6000-9000 | 6,0-10,0 | slachtoffer is doodziek; veel mensen sterven binnen twee maanden |
| >10.000 | >10,0 | bijna iedereen overlijdt |
Wanneer men in hun werk aan 100 millisievert zijn blootgesteld, is de kans op kanker tot hun 75e jaar niet 23% maar 24%. Hieruit blijkt dat invloed van lage dosis straling eigenlijk niet vast te stellen is. Elke vorm van straling kan kanker veroorzaken. De practici stellen dat als 1 sievert binnen een groep mensen duizend kankergevallen veroorzaakt dan zal een halve sievert binnen diezelfde groep 500 kanker gevallen veroorzaken. Anderen vragen zich af of er geen minimum grens is waaronder geen kankergevallen optreden omdat het lichaam nieuwe fouten in de DNA repareert. Men gaat voorlopig uit van de eerst genoemde lineaire hypothese d.w.z. dat straling vanaf dosis nul in beginsel invloed heeft op het inleiden van kanker.
Halfwaardetijd de maat voor straling intensiteit
Halfwaarde tijd of halveringstijd is de tijd dat de helft van radioactieve atoomkernen is vervallen. Cesium-137 heeft een halfwaardetijd van 30 jaar, plutonium-239 van 24000 jaar, jodium-129 van 15 miljoen jaar, uranium(235) 700 miljoen jaar en jodium (131) 8 dagen. Hoe korter de halfwaardetijd, des te radioactiever een stof is, maar hoe eerder de straling stopt. Een korrel uranium zal door de lange halfwaardetijd niet veel uitstralen en die kun je met de hand oppakken. De halfwaardetijd is groot dus is er per seconde weinig straling.(Isotopen)De Code achter atomen
Atoom-eigenschappen worden bepaald door aantal protonen en neutronen in de atoomkern. Om deze kern zwerven elektronen, het aantal protonen is gelijk aan het aantal elektronen. In de kern stoten protonen elkaar af als er geen neutronen in zitten. Door extra neutronen in de kern veranderen de eigenschappen van het materiaal niet, maar het materiaal wordt instabiel dus radioactief.Jodium(131) en Cesium(137)
Voorbeeld: Jodium (127) met 74 neutronen in de kern is stabiel. Zo komt het in de natuur voor. Tijdens uraniumverval ontstaat jodium (131), er zitten vier neutronen teveel in de kern. De helft van de atomen vervalt in acht dagen. Natuurlijk cesium (133) met 78 neutronen is stabiel. Cesium (137) dat vrijkomt uit de atoomcentrale in Japan heeft vier neutronen teveel, de helft vervalt in 30 jaar.
Deze twee stoffen zijn gevaarlijk. Het radioactieve Jodium (131) straalt door zijn korte halveringstijd heftiger dan cesium (137) maar is dus relatief snel geneutraliseerd. Jodium (131) wordt opgenomen door de schildklier waardoor die aangetast wordt. Een manier om dat te voorkomen is door de schildklier te verzadigen met stabiel jodium (127). De schildklier kan dan de radioactieve isotoop niet opnemen.
Het cesium is een groter probleem, omdat het langer aanwezig blijft wegens zijn lange halveringstijd en chemisch lijkt op kalium dat we nodig hebben en zich bevindt verspreid in ons lichaam. Het lichaam kan cesium niet onderscheiden van kalium en het wordt daardoor opgenomen in ons lichaam. Het is daarom belangrijk om te weten wat de verhouding jodium en cesium is in de radioactieve bron. Jodium vervalt snel en er is na ongeveer tachtig dagen geen straling meer; in het geval van cesium zitten we veel langer met het probleem en kan schade aangericht worden.
Ook maakt het uit of het cesium op kleigrond of op zandgrond terechtkomt. Klei zal het cesium aan zich binden, waardoor het niet meer vrij in de lucht hangt. Daarbij is het dan mogelijk om de besmette kleigrond af te graven en ergens te begraven waar de straling minder schade kan veroorzaken.